
某兴趣小组为探究外界条件对可逆反应 A(g)+B(g) C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ. C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
|
 C(g)+D(s)来判断,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时,第Ⅰ组消耗的B的物质的量与A的物质的量相等,故a=0.05mol?L-1;
C(g)+D(s)来判断,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时,第Ⅰ组消耗的B的物质的量与A的物质的量相等,故a=0.05mol?L-1;| 0.05mol?L-1 |
| 0.05mol?L-1×0.05mol?L-1 |
| 0.05×10 |
| 1 |
| 0.122mol?L-1 |
| 0.078mol?L-1×0.078mol?L-1 |
| 0.04mol?L-1 |
| 0.06mol?L-1×0.06mol?L-1 |
| 0.04×10 |
| 1 |
| 0.098mol?L-1 |
| 0.07mol?L-1×0.07mol?L-1 |
| 0.098mol?L-1 |
| 0.07mol?L-1×0.07mol?L-1 |
| 0.122mol?L-1 |
| 0.078mol?L-1×0.078mol?L-1 |


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.| A | B | C | D | |
| Ⅰ | 0.05mol?L-1 | a mol?L-1 | 0.05mol?L-1 | b mol |
| Ⅱ | 0.078mol?L-1 | 0.078mol?L-1 | 0.122mol?L-1 | m mol |
| Ⅲ | 0.06mol?L-1 | 0.06mol?L-1 | 0.04mol?L-1 | n mol |
| Ⅳ | 0.07mol?L-1 | 0.07mol?L-1 | 0.098mol?L-1 | p mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
(2011·烟台诊断)某兴趣小组为探究外界条件对可逆反应A(g)+B(g) C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
|
| A | B | C |
| Ⅰ | 0.050 mol·L-1 | 0.050 mol·L-1 | 0.050 mol·L-1 |
| Ⅱ | 0.070 mol·L-1 | 0.070 mol·L-1 | 0.098 mol·L-1 |
| Ⅲ | 0.060 mol·L-1 | 0.060 mol·L-1 | 0.040 mol·L-1 |
| Ⅳ | 0.080 mol·L-1 | 0.080 mol·L-1 | 0.12 mol·L-1 |
针对上述系列实验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20 mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,通过压缩容器的体积就可以实现
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省四地六校高三上学期第三次月考化学试卷(解析版) 题型:选择题
某兴趣小组为探究外界条件对可逆反应A(g)+B(g)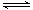 C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
针对上述系列实验,下列结论中错误的是( )
|
|
A |
B |
C |
|
Ⅰ |
0.050mol·L-1 |
0.050mol·L-1 |
0.050mol·L-1 |
|
Ⅱ |
0.070mol·L-1 |
0.070mol·L-1 |
0.098mol·L-1 |
|
Ⅲ |
0.060mol·L-1 |
0.060mol·L-1 |
0.040mol·L-1 |
|
Ⅳ |
0.080mol·L-1 |
0.080mol·L-1 |
0.12mol·L-1 |
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,只能通过压缩容器的体积才可以实现
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高考化学一轮复习《化学反应速率与化学平衡》专题综合测试(苏教版) 题型:选择题
(2011·烟台诊断)某兴趣小组为探究外界条件对可逆反应A(g)+B(g)  C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
|
|
A |
B |
C |
|
Ⅰ |
0.050 mol·L-1 |
0.050 mol·L-1 |
0.050 mol·L-1 |
|
Ⅱ |
0.070 mol·L-1 |
0.070 mol·L-1 |
0.098 mol·L-1 |
|
Ⅲ |
0.060 mol·L-1 |
0.060 mol·L-1 |
0.040 mol·L-1 |
|
Ⅳ |
0.080 mol·L-1 |
0.080 mol·L-1 |
0.12 mol·L-1 |
针对上述系列实验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20 mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,通过压缩容器的体积就可以实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com