
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +2 | -2 |
分析 短周期元素,由元素的化合价可知,Q只有-2价,Z有+6、-2价,则Q为O元素、Z为S元素;L有+7、-1价,则L为氯元素;X、M都有+2价,处于ⅡA族,原子半径X>M,则X为Mg元素、M为Be;Y为+3价,处于ⅢA族,原子半径大于硫,所以Y为Al元素,结合元素周期律及物质的量结构与性质解答.
解答 解:短周期元素,由元素的化合价可知,Q只有-2价,Z有+6、-2价,则Q为O元素、Z为S元素;L有+7、-1价,则L为氯元素;X、M都有+2价,处于ⅡA族,原子半径X>M,则X为Mg元素、M为Be;Y为+3价,处于ⅢA族,原子半径大于硫,所以Y为Al元素.
(1)Y与Q形成的化合物为Al2O3,与氢氧化钠反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(2)非金属性Cl>S,故氢化物稳定性HCl>H2S,
故答案为:HCl;H2S;
(3)同周期自左而右金属性减弱,故镁的金属性比铝的强,
a.Mg、Al两种元素在空气中久置,金属表面有氧化物膜,分别放入热水中,不能根据反应判断金属性强弱,故a错误;
b.两种元素的单质分别和同浓度的盐酸反应,反应越剧烈,说明金属性越强,故b正确;
c.两种元素的单质分别和热水作用,并滴入酚酞溶液,溶液碱性越强,说明金属性越强,故c正确;
d.二者都是金属,没有气态氢化物,不能比较氢化物的稳定性判断金属性强弱,故d错误,
故答案为:镁;bc.
(4)上述六种元素中最高价氧化物对应的水化物酸性最强的是:HClO4,
故答案为:HClO4.
点评 本题考查元素的性质与位置关系,关键是利用原子半径及化合价来推断出元素,熟悉掌握元素周期律,注意金属性、非金属强弱比较实验事实.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
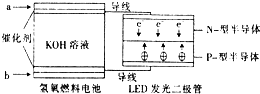 LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )| A. | P-型半导体连接的是电池负极 | |
| B. | b处为电池正极,发生了还原反应 | |
| C. | a处通入氢气,发生还原反应 | |
| D. | 该装置中只涉及两种形式的能量转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都不可用铝制容器贮存 | |
| B. | 常温下都能与铜较快反应 | |
| C. | 露置于空气中,溶液浓度均降低 | |
| D. | 在空气中长期露置,溶液质量均减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价键强弱可决定分子晶体的熔、沸点高低 | |
| B. | O2、CO2、N2都是非极性分子 | |
| C. | C3H8中碳原子都采用的是sp3杂化 | |
| D. | CO的一种等电子体为NO+,它的电子式为 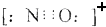 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 作为相对原子质量标准的原子${\;}_{6}^{14}$C | |
| B. | 氯化镁的电子式: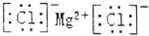 | |
| C. | 用电子式表示氯化氢分子的形成过程: | |
| D. | HClO的结构式为:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①④ | B. | 只有③⑤ | C. | 只有②③ | D. | 只有①④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com