


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氢氟酸易与SiO2反应,氢氟酸可用于刻蚀玻璃 |
| B、Al与Fe2O3会发生铝热反应,可用于焊接钢轨 |
| C、NH3具有碱性,可用NH3与灼热的CuO反应制取少量N2 |
| D、Fe具有良好导电性,可用铁片作电解食盐水的阴极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾水解形成的Al(OH)3胶体能杀菌消毒,可用于水的净化 |
| B、镀锡的铁制品比镀锌的铁制品耐用 |
| C、乙醇和乙酸都能溶于水,都是电解质 |
| D、分别与等物质的量的HC1和CH3COOH恰好中和时,消耗NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O | ||
| B、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- | ||
| C、向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | ||
D、向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
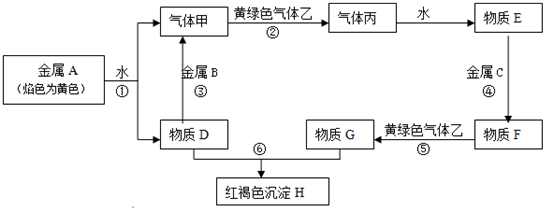
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 )的单体.某课题组用有机物A(分子式C4H9Br,分子中有3个甲基)和甲醇为有机原料合成H.合成路线如下:
)的单体.某课题组用有机物A(分子式C4H9Br,分子中有3个甲基)和甲醇为有机原料合成H.合成路线如下:
查看答案和解析>>
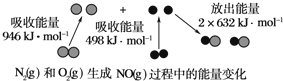
科目:高中化学 来源: 题型:
| A、△H3=2△H1-△H2 |
| B、△H3=△H1+△H2 |
| C、△H3=2△H1+△H2 |
| D、△H3=△H2-△H1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com