(2012?南开区一模)图中B、F为单质,其他为化合物,它们之间存在如下转化关系(部分反应物、生成物及反应条件已略去).其中,A、C是工业上用途很广的两种重要化工原料,C的焰色反应为黄色,B为日常生活中常见的金属,H、G分子均具有正四面体结构,H是一种重要的能源.J是一种较好的耐火材料,K是极易溶于水的碱性气体,请回答下列问题:
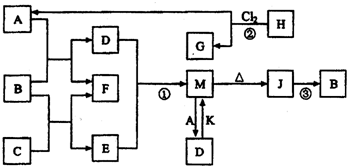
(1)C中存在的化学键类型为
离子键和共价键
离子键和共价键
;G的电子式为
.
(2)反应②进行的条件
光照、过量氯气
光照、过量氯气
.
(3)反应①的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.
反应③的化学方程式为为
.
(4)向D溶液中通入K可生成M和另一种物质X,写出鉴定X中阳离子的实验方法和现象为
取少量X溶液于试管中,用胶头滴管滴入NaOH溶液,将湿润的红色石蕊试纸置于试管口,加热试管,可观察到红色石蕊试纸变蓝
取少量X溶液于试管中,用胶头滴管滴入NaOH溶液,将湿润的红色石蕊试纸置于试管口,加热试管,可观察到红色石蕊试纸变蓝
.
(5)碘和氯的原子序数之差为36,放射性131的原子核内中子数为
78
78
,碘在元素周期表中的位置为
第五周期第ⅦA族
第五周期第ⅦA族
.
(6)我国首创的海洋电池以B单质为负极,铂网为正极,海水为电解质溶液,空气中的氧气与B反应产生电流.该电池的正极反应式为
O2+2H2O+4e-=4OH-(或3O2+6H2O+12e-=12OH-)
O2+2H2O+4e-=4OH-(或3O2+6H2O+12e-=12OH-)
.

 (1)C中存在的化学键类型为
(1)C中存在的化学键类型为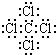

 ,故答案为:离子键、共价键;
,故答案为:离子键、共价键; ;
;
