
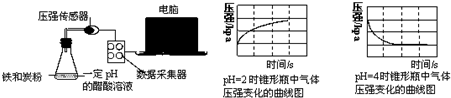
| A. | 析氢腐蚀和吸氧腐蚀的速率一样快 | |
| B. | 在酸性溶液中生铁可能发生吸氧腐蚀 | |
| C. | 溶液pH≤2时,生铁发生析氢腐蚀 | |
| D. | 两溶液中负极反应均为:Fe-2e-═Fe2+ |
分析 根据压强与时间关系图知,pH=2的醋酸溶液中压强随着反应的进行而逐渐增大,说明该反应发生析氢腐蚀,pH=4的醋酸溶液中压强随着反应的进行而逐渐减小,说明发生吸氧腐蚀,根据原电池原理来分析解答.
解答 解:A、根据压强与时间关系图知,pH=2的溶液和pH=4的溶液中,变化相同的压强时所用时间不同,前者比后者使用时间长,说明吸氧腐蚀速率大于析氢腐蚀速率,故A错误;
B、pH=4的醋酸溶液中压强随着反应的进行而逐渐减小,说明发生吸氧腐蚀,pH=4的醋酸溶液呈酸性,所以在酸性溶液中生铁可能发生吸氧腐蚀,故B正确;
C、根据PH=2的溶液中压强与时间的关系知,压强随着反应的进行而逐渐增大,说明该装置发生析氢腐蚀,则溶液pHpH≤2时,生铁发生析氢腐蚀,故C正确;
D、两个溶液中都发生电化学腐蚀,铁均作负极,电极反应式为Fe-2e-=Fe2+,故D正确;
故选A.
点评 本题考查了析氢腐蚀和吸氧腐蚀,根据压强与时间的关系分析吸氧腐蚀和析氢腐蚀、反应速率大小、电极反应等知识点,难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③⑤ | C. | ③⑤ | D. | 只有① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合物的总质量 | ||
| C. | B的物质的量浓度 | D. | 气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极反应式为:3Zn-6e-+6OH-═3Zn(OH)2 | |
| B. | 充电时阳极反应式为:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH- | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 | |
| D. | 放电时正极附近溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| B. | 1 L 0.5 mol•L-1硝酸钡溶液中所含NO3-数为0.5 NA | |
| C. | 2.4g Mg与足量的氮气完全反应失去的电子数为0.2NA | |
| D. | 在标准状况下,11.2L H2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品中加入维生素或钙、硒等是为了补充食品中缺乏的营养成分 | |
| B. | 抗生素能消炎抗菌,经常大量食用对人体有益无害 | |
| C. | 使用青霉素可能产生过敏反应,用药前一定要进行皮肤敏感试验 | |
| D. | 服用麻黄碱后可明显增加运动员的兴奋程度,但对其身体有极大的副作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体摩尔体积为22.4L/mol | B. | 1molNaOH的质量为40g | ||
| C. | 0.5molCO2的体积为11.2L | D. | H2O的摩尔质量为18g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com