
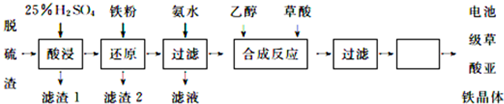
分析 脱硫渣(主要成分为 Fe2O3 )用硫酸溶解,过滤除去不溶物,滤液中主要含有硫酸铁、硫酸等,进入铁粉还原得到硫酸亚铁,过滤分离,滤液中通入氨气,得到氢氧化亚铁沉淀,过滤分离,滤液中含有硫酸铵,氢氧化亚铁与草酸化合得到草酸亚铁,再经过过滤、洗涤、干燥得到草酸亚铁晶体.
(1)硫酸铁与Fe反应生成硫酸亚铁,硫酸与Fe反应生成硫酸亚铁与氢气;
(2)TiOSO4水解能生成 H2TiO3沉淀,还生成硫酸;
(3)滤液中含有硫酸铵;
(4)过滤后,再经过洗涤、干燥得到草酸亚铁晶体;
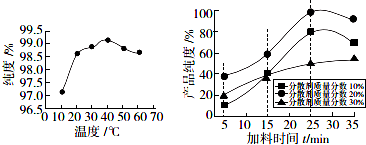
(5)应选择纯度最高时的温度、加料时间、分散剂的质量分数;
(6)反应方程式为:10FeC2O4•2H2O+6KMnO4+24 H2SO4=5Fe2(SO4)3+20 CO2↑+6MnSO4+3K2SO4+24H2O,结合方程式计算.
解答 解:脱硫渣(主要成分为 Fe2O3 )用硫酸溶解,过滤除去不溶物,滤液中主要含有硫酸铁、硫酸等,进入铁粉还原得到硫酸亚铁,过滤分离,滤液中通入氨气,得到氢氧化亚铁沉淀,过滤分离,滤液中含有硫酸铵,氢氧化亚铁与草酸化合得到草酸亚铁,再经过过滤、洗涤、干燥得到草酸亚铁晶体.
(1)“还原”过程中反应的离子方程式还有:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
(2)TiOSO4水解能生成 H2TiO3沉淀,还生成硫酸,反应方程式为:TiOSO4+H2O=H2TiO3↓+H2SO4,
故答案为:TiOSO4+H2O=H2TiO3↓+H2SO4;
(3)滤液中含有硫酸铵,经处理后得到一种农业上常用的化肥,
故答案为:硫酸铵;
(4)过滤后,再经过洗涤、干燥得到草酸亚铁晶体,
故答案为:洗涤、干燥;
(5)从图象可知,反应温度40℃纯度最高,在加料时间为 25min、分散剂的质量分数为20%,纯度最佳,
故答案为:40;25;20%;
(6)配平后反应方程式为:10FeC2O4•2H2O+6KMnO4+24 H2SO4=5Fe2(SO4)3+20 CO2↑+6MnSO4+3K2SO4+24H2O,可知n(FeC2O4•2H2O)=$\frac{10}{6}$n(KMnO4)=$\frac{10}{6}$×V×10-3 L×c mol•L-1,
故m(FeC2O4•2H2O)=$\frac{10}{6}$×V×10-3 L×c mol•L-1×180g/mol=0.3cV g,
故FeC2O4•2H2O的纯度为$\frac{0.3cVg}{wg}$×100%=$\frac{30cV}{w}$%,
故答案为:$\frac{30cV}{w}$.
点评 本题考查物质准备工艺流程、物质含量测定、物质的分离提纯、对条件控制的选择、氧化还原反应滴定等,需要学生具备扎实的基础,是对学生综合能力的考查,题目难度中等.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生中和反应 | 不反应 | 溶解 | 生成氢气 |
| B | 不反应 | 有银镜反应 | 有红色沉淀 | 放出氢气 |
| C | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 641.0 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-O | O=O |
| 键能/KJ?mol-1 | 463.4 | 498 |
| A. | 413KJ/mol | B. | 557KJ/mol | C. | 221.6KJ/mol | D. | 436KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
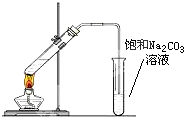 实验室可以用图所示的装置制取乙酸乙酯.回答下列问题:
实验室可以用图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜作负极 | B. | 锌作正极 | ||
| C. | 电子由铜经导线流向锌 | D. | 锌片上的反应为:Zn-2e-=Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com