
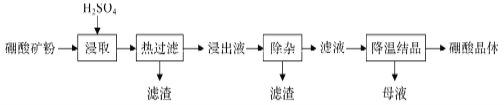
【题目】以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、A12O3)为原料生产硼酸的工艺流程如下:
已知:表一:不同温度下H3BO3的溶解度
温度℃) | 20 | 40 | 60 | 100 |
溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
表二:不同物质沉淀完全时的pH
物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为_________________________。
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量H2O2和MgO,可以除去的杂质离子为_______________________,H2O2的作用为_____________________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的为__________________________。
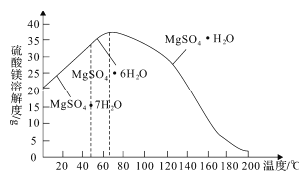
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的措施是将“母液”蒸发浓缩,____________________________________。
(5)己知25℃时,硼酸(H3BO3)溶液中存在如下平衡:H3BO3![]() [B(OH)4]-(aq)+H+(aq);K=5.7×10-10;25℃时,0.7mol·L-1硼酸溶液中c(H+)=__________mol·L-1。
[B(OH)4]-(aq)+H+(aq);K=5.7×10-10;25℃时,0.7mol·L-1硼酸溶液中c(H+)=__________mol·L-1。
(6)已知25℃时:
化学式 | H2CO3 | CH3COOH |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是________(填选项字母)。
a.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
b.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
c.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
d.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者
【答案】分批慢慢加入硫酸(或边加入边搅拌)Fe3+、Fe2+、Al3+H2O2+2H++2Fe2+=2Fe3++2H2O防止因温度下降使H3BO3从溶液中析出加压升温结晶(或加压升温结晶并过滤)2×10-5bd
【解析】
(1)CaCO3与硫酸反应生成二氧化碳、硫酸钙和水,该反应的化学方程式为:CaCO3 (粉末)+H2SO4=CaSO4+H2O+CO2↑,由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,故应分批慢慢加入H2SO4;故答案为:应分批慢慢加入H2SO4 ;
(2)加适量H2O2把Fe2+氧化为Fe3+,所以H2O2的作用是:H2O2+2H++2Fe2+=2Fe3++2H2O,加MgO调节pH,使Fe3+、Al3+转化为沉淀而除去,所以除去的离子有Fe3+、Fe2+、Al3+;故答案为:Fe3+、Fe2+、Al3+;H2O2+2H++2Fe2+=2Fe3++2H2O;
(3)由题目信息可知:H3BO3的溶解度随温度的升高而增大,所以要采用“热过滤”,以防温度下降时H3BO3从溶液中析出;故答案为:防止温度下降时H3BO3从溶液中析出;
(4)根据图可知温度越高MgSO4H2O的溶解度越小,由于溶液的沸点随压强增大而升高,为了防止溶液沸腾,应该在较高的压强条件下加热,使MgSO4H2O结晶析出,故答案为:加压升温结晶;
(5)25℃时0.7molL-1硼酸溶液中H+的浓度:c(H+)=![]() =
=![]() mol/L≈2×10-5molL-1,故答案为:2×10-5molL-1;
mol/L≈2×10-5molL-1,故答案为:2×10-5molL-1;
(6)相同温度、浓度下,酸的电离平衡常数越大,酸的酸性越强,其酸根离子的水解能力越小,根据电离平衡常数知,酸性强弱顺序是CH3COOH>H2CO3>H3BO3>HCO3-,所以离子水解能力碳酸根离子>碳酸氢根离子>醋酸根离子。a.酸性H2CO3>H3BO3>HCO3-,所以碳酸钠溶液滴入硼酸中生成碳酸氢钠和硼酸钠,没有气体生成,故a错误;b.酸性CH3COOH>H2CO3,所以碳酸钠溶液滴入醋酸中生成醋酸钠、水和二氧化碳,所以能看到有气泡生成,故b正确;c.酸性H2CO3>H3BO3,所以碳酸的电离程度大于硼酸,则等浓度的碳酸和硼酸溶液比较,碳酸的酸性大于硼酸,所以pH:前者<后者,故c错误;d.酸性CH3COOH>H2CO3,所以碳酸根离子水解能力大于醋酸根离子,则等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者,故d正确;故答案为:bd.


科目:高中化学 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验能获得成功的是( )
A.用稀硫酸与乙醇混合液共热控制在170℃制乙烯气体
B.将铁屑、溴水、苯混合制溴苯
C.在苯酚溶液中滴入少量稀溴水出现白色沉淀
D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)常温下为无色液体,是应用广泛的化工原料和前景乐观的燃料。
(1)①己知:CO、H2、CH3OH的燃烧热(△H)分别为﹣283.0 kJmol-1、﹣285.8 kJmol-1、-726.8 kJmol-1,则CO和H2反应生成CH3OH的热化学方程式是________________。
②有人设想综合利用太阳能将天然气转化为较易存运的甲醇,装置如下图,装置工作时阳极反应方程式为_________________________________。

(2)一定温度下反应CO(g)+2H2(g)=CH3OH(g)在容积为2L的密闭容器中进行,其相关数据见上图。
①从反应开始至平衡时,用H2表示化学反应速率为__________,该温度下此反应的平衡常数为__________;
②5min后速率变化加剧的原因可能是___________________________;
(3)在6.98MPa、250℃和催化剂(CoI2)作用下,甲醇可转化为乙酸:
CH3OH(g) + CO(g) = CH3COOH(g)
有机合成常有副反应存在。若反应釜中CH3OH和CO配料比(质量)为1,甲醇生成乙酸的选择率为90.0%,则此反应CO的转化率为___________。
(4)常温Ka(CH3COOH)=1.8×10-5, 0.1 molL-1CH3COOH溶液中滴加0.1 molL-1CH3COONa溶液至 pH=7,此时混合溶液中两溶质的物质的量比n(CH3COOH):n(CH3COONa)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”就是因为酒在贮存过程中生成了有香味的乙酸乙酯。在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题。

(1)乙烯制取乙醇的化学方程式:__________________________。
(2)写出制取乙酸乙酯的化学反应方程式:________________________。
(3)浓硫酸的作用:_______________________________。
(4)饱和碳酸钠溶液的主要作用是________________________________________。
(5)装置中导管要在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是__________。
(6)若要把制得的乙酸乙酯分离出来,应该采用的实验操作是___________________。
(7)做此实验时,有时还要向盛有乙酸乙酯的试管里加入几块碎瓷片,其目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前20号元素W、X、Y、Z的原子序数依次增大,且分列四个不同周期和四个不同主族。其中A为Y元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物;常温下乙为液体。下列说法正确的是

A. 简单离子半径:Z>Y
B. 反应①为吸热反应
C. 反应②为工业上制备漂白粉的反应原理
D. X、Y分别与Z形成的化合物中,化学键类型一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A. 用FeCl3溶液腐蚀铜箔制作印刷电路板:Fe3++Cu=Cu2++Fe3+
B. 用Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4![]() CaCO3+SO42-
CaCO3+SO42-
C. 碳酸钠溶液显碱性:CO32-+2H2O=HCO3-+2OH-
D. 用NaOH溶液吸收氯气:Cl2+2OH-=2Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)![]() 2C(g) △H<0。t1 时刻达到平衡后,在t2 时刻改变某一条件,其反应过程如图所示。下列说法正确的是
2C(g) △H<0。t1 时刻达到平衡后,在t2 时刻改变某一条件,其反应过程如图所示。下列说法正确的是

A. 0~t2时间段内,υ正> υ逆
B. I、Ⅱ两过程达到平衡时,A的体积分数I﹥II
C. t2时刻改变的条件可能是向密闭容器中加C
D. I、II两过程达到平衡时,平衡常数I﹤II
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算铜元素相对原子质量。提供的实验仪器及试剂如下(根据需要可重复选用,加入的氯化铵与氢氧化钙的量足以产生使氧化铜完全还原的氨气):
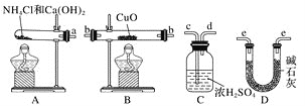
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________。
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________。
(3)在本实验中,若测得m(CuO)=ag,m(H2O)=bg,则Ar(Cu)=_____________________。
(4)在本实验中,使测定结果Ar(Cu)偏大的是________________(填序号)。
①氧化铜未完全起反应 ②氧化铜不干燥 ③氧化铜中混有不反应的杂质 ④ 碱石灰不干燥 ⑤氯化铵与氢氧化钙混合物不干燥
(5)在本实验中,还可通过测定________和________,或________和________达到实验目的。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com