

分析 含镍(Ni2+)废液为原料生产NiOOH,在含Ni+的废液中中加入碳酸钠溶液,过滤得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入试剂调节溶液的pH使镍离子全部沉淀生成Ni(OH)2,在空气中加热Ni(OH)2制取NiOOH,
(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀,过滤用到的玻璃仪器有烧杯、漏斗、琉璃棒;
(2)碳酸镍与稀硫酸反应生成硫酸镍、二氧化碳、水,根据电荷守恒和元素守恒可写出反应的离子方程式;
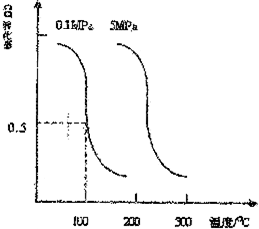
(3)合成氨的相对初始速率随催化剂中n值增大而增大,而n增大,Co2+的比例增大;
(4)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水;
(5)消耗KMnO4物质的量:0.01 mol•L-1×0.01L=1×10-4mol,根据电子得失守恒可知Ni(OH)2的物质的量为5×10-4mol,可计算得混合物中Ni(OH)2的质量,再计算出NiOOH的质量,确定NiOOH的物质的量,依据xNiOOH•yNi(OH)2计算x和y的比值.
解答 解:含镍(Ni2+)废液为原料生产NiOOH,在含Ni+的废液中中加入碳酸钠溶液,过滤得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入试剂调节溶液的pH使镍离子全部沉淀生成Ni(OH)2,在空气中加热Ni(OH)2制取NiOOH,
(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀,具体操作步骤为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成,过滤用到的玻璃仪器有烧杯、漏斗、玻璃棒;
故答案为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成;漏斗、玻璃棒;
(2)碳酸镍与稀硫酸反应生成硫酸镍、二氧化碳、水,反应的离子方程式为NiCO3+2H+=Ni2++H2O+CO2↑,
故答案为:NiCO3+2H+=Ni2++H2O+CO2↑;
(3)由图可知,随n值越大,合成氨的相对初始速率越大,而n增大,Co2+的比例增大,故Co2+的催化活性更高,
故答案为:Co2+;
(4)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水,原子守恒配平书写化学方程式为:4Ni(OH)2+O2$\frac{\underline{\;△\;}}{\;}$4NiOOH+2H2O,
故答案为:4Ni(OH)2+O2$\frac{\underline{\;△\;}}{\;}$4NiOOH+2H2O;
(5)消耗KMnO4物质的量:0.01 mol•L-1×0.01L=1×10-4 mol,根据电子得失守恒可知Ni(OH)2的物质的量为5×10-4mol,则样品中总Ni(OH)2的物质的量为5×10-4 mol×$\frac{500}{25}$=0.01mol,
n(NiOOH)=$\frac{9.21g-0.01mol×92.7g/mol}{91.7g/mol}$=0.09 mol
x:y=n(NiOOH):n[Ni(OH)2]=0.09 mol:0.01 mol=9:1,
故答案为:9:1.
点评 本题考查了物质分离方法和实验过程分析判断,溶度积常数和离子积常数的计算应用,注意流程的理解应用,掌握实验基础和物质性质是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 研究和开发CO2 和CO的创新利用是环境保护和资源利用的双赢的课题.
研究和开发CO2 和CO的创新利用是环境保护和资源利用的双赢的课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
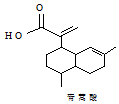
| A. | 青蒿酸的分子式为C15H20O2 | |
| B. | 1mol青蒿酸最多可与3molH2加成 | |
| C. | 青蒿酸与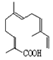 互为同分异构体 互为同分异构体 | |
| D. | 苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=$\frac{PM}{2000ρ}$ | B. | P=$\frac{200ρa}{M}$ | C. | P$\frac{1000ρ×a%}{M}$×2 | D. | V×ρ×a%=$\frac{PMV}{1000}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水应密闭保存,放置于低温处 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使气体颜色变深 | |
| C. | 生产硝酸的过程中使用过量空气以提高氨气的利用率 | |
| D. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com