
����Ŀ����ͼ��ʾ��U�ι���ʢ��100mL����Һ����Ҫ��ش��������⣺ 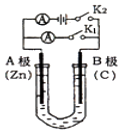
��1����K2 �� �պ�K1 �� ����ʢ��ҺΪCuSO4��Һ����AΪ����B���ĵ缫��ӦʽΪ �� ����ʢ��ҺΪKCl��Һ����B���ĵ缫��ӦʽΪ �� K+����������A��B��
��2����K1 �� �պ�K2 �� ����ʢ��ҺΪ���з�̪��NaCl��Һ���� ��A�缫�����ɹ۲쵽�������� �� �ܷ�Ӧ��ѧ����ʽ�� ��
�ڷ�Ӧһ��ʱ����K2 �� ��������Һ������仯��������ܽ⣬B������������������״����Ϊ11.2mL������Һ��ֻ�ϣ���Һ��pHԼΪ �� ��Ҫʹ�������Һ�ָ���ԭ״̬������U�ι��ڼ����ͨ��һ������ ��
��3����Ҫ�õ�ⷽ��������ͭ����K1 �� �պ�K2 �� ���Һѡ��CuSO4��Һ����A�缫�IJ���Ӧ������ �� ��Ӧһ��ʱ���������Һ��Cu2+Ũ�������������С���������䡱����
���𰸡�
��1������Cu2++2e���TCu��O2+2H2O+4e��=4OH����B
��2��������ɫ���ݣ���Һ���ɫ��2NaCl+2H2O ![]() 2NaOH+H2��+Cl2����12��HCl
2NaOH+H2��+Cl2����12��HCl
��3����ͭ����С
���������⣺��1����K2 �� �պ�K1 �� ��װ��Ϊԭ��أ�A����Zn��ʧ������������B����C��������B�缫��ͭ���ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪCu2++2e���TCu������ʢ��ҺΪKCl��Һ��B�缫�������õ��ӷ�����ԭ��Ӧ���缫������ΪO2+2H2O+4e��=4OH�����������Һ�����������ƶ����������������ƶ������Լ�����������B�ƶ��� ���Դ��ǣ�����Cu2++2e���TCu��O2+2H2O+4e��=4OH����B����2����K1 �� �պ�K2 �� ��װ���ǵ��أ�AΪ������BΪ������
����ʢ��ҺΪ���з�̪��NaCl��Һ��
��A�缫��ˮ�õ�������������ͬʱ��Һ�л�����OH�� �� ����A��������Һ������ǿ����Һ���ɫ������A�缫�Ͽ����������Dz�����ɫ���ݣ���Һ���ɫ��
B�缫�������ӷŵ�������������ط�ӦʽΪ2NaCl+2H2O ![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
���Դ��ǣ�������ɫ���ݣ���Һ���ɫ��2NaCl+2H2O ![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
�ڷ�Ӧһ��ʱ����K2 �� ��������Һ������仯��������ܽ⣬B������������������״����Ϊ11.2mL������2NaCl+2H2O ![]() 2NaOH+H2��+Cl2����c��NaOH��=
2NaOH+H2��+Cl2����c��NaOH��= ![]() =0.01mol/L������Һ��pH=12��
=0.01mol/L������Һ��pH=12��
���������������������������������������������൱������HCl����Ҫʹ�������Һ�ָ���ԭ״̬�����ݡ�����ʲô����ʲô��ԭ���������Ӧ����HCl��
���Դ��ǣ�12��HCl����3����Ҫ�õ�ⷽ��������ͭ����K1 �� �պ�K2 �� ���Һѡ��CuSO4��Һ����ͭ����������ͭ������������AӦ���Ǵ�ͭ��BΪ��ͭ���ܽ��CuС��������Cu��������Һ��ͭ����Ũ�ȼ�С��
���Դ��ǣ���ͭ����С��


 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڹ�ҵ��������Ҫ����;��ij��ȤС����ʵ������ģ�ҵ���������Ʊ���ˮ�Ȼ�������ˮAlCl3(183������)����ʪ������������������������������װ���Ʊ���

��1��װ��B��ʢ��____��Һ��C��F��װ����ͬһ���Լ������Լ�Ϊ________________��
��2��װ��A��Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_______________________________��
��3��ʵ�鲽������ͼ����װ�ú��ȼ���װ������������װҩƷ��Ȼ���ȼ___________(����A������C��)���ƾ��ƣ���____����ʵ��������ʱ���ٵ�ȼ___________(����A������C��)���ƾ��ơ�
��4��װ��G��������__________________��д��G�з�Ӧ�����ӷ���ʽ_____________________��
��5����ͬѧ��Ϊװ��D��E�м��ϸ�������ܻ��ɴֵIJ�������Ϊʲô?___________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊ����ɫ��ij��������һ�֡�ѩ��������ɫ�����ѩ���������£��������ѷ����ܱ�״̬���õ��������ڣ����һ��֧��С�������ڷ�����ǣ�����ʹ����ۻ���ȼ�գ��������ң���ѩ�������Ƴ��ˣ���ѩ�����������ã��������к���������ѩ�������õ��ǣ�������
A.��Ļ�ԭ��
B.���Ư����
C.��������Ļ�ԭ��
D.���������Ư����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϊ98%��Ũ���ᣨ��=l.84g��cm-3������240mLl.84mol��L-1ϡ���ᣬ���в�����ȷ���� ( )
A. ������ˮ����ע��ʢ��һ����Ũ������ձ��У������Ͻ�������ȴ
B. ����Ķ���������100mL��Ͳ��250mL����ƿ��������ƽ
C. ��������ƿ�м�������ˮ�������õ�Ũ����ע������ƿ����ˮ����
D. ��ȡŨ��������Ϊ25.0mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ȼ�յ�˵����ȷ���� ����
A.ȼ��һ��Ҫ�������μ�B.�з�������ı仯һ����ȼ��
C.ȼ��һ���з��ⷢ������D.ȼ�յ�������һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش��������⣮
��1��ˮ�ĵ���ƽ��������ͼ��ʾ����A���ʾ25��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ�B���ʾ100��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ� 
��100��ʱ1molL��1��NaOH��Һ�У���ˮ�������c��H+��=molL��1 �� KW��25�棩KW��100�棩�����������������=������
��25��ʱ����ˮ�ĵ���ƽ����ϵ�м�������NH4Cl���壬��ˮ�ĵ���ƽ���Ӱ��������ٽ����������ơ���Ӱ�족����
��2������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ����������֪������ݣ�
��ѧʽ | ����ƽ�ⳣ����25�棩 |
HCN | K=4.9��10��10 |
CH3COOH | K=1.8��10��5 |
H2CO3 | K1=4.3��10��7��K2=5.6��10��11 |
��25��ʱ���е�Ũ�ȵ�a��NaCN��Һ b��CH3COONa ��Һ c��Na2CO3��Һ��������Һ��pH�ɴ�С��˳��Ϊ��������ţ�
��25��ʱ����Ũ�ȵ�CH3COOH��Һ��NaOH��Һ�������ϣ���c��Na+��c��CH3COO���������������������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ����������Ϣ�����Ĺؼ����ϡ�
��1����Ԫ��λ�����ڱ���__________����_________�塣�����йع���ϵ�˵������ȷ����________(����ĸ)��
A.̼���軯ѧ�����ȶ�����������������ˮ��
B.������Ӳ�ȴ��۵�ߣ����������������մɺ����
C.�ߴ��ȵĶ���������������������ͨѶ���Ϲ��ά
D.��ͨ�������ɴ��ʯ��ʯ��ʯӢɰ�Ƴɵģ����ڲ�����ڵ�ȼH2ʱ���ֻ�ɫ����
E. ���������跴Ӧ���ʲ�������Ϊ��Һ�ⵥ����
��2����ҵ����ʯӢɰ�ͽ�̿���Ƶôֹ衣
��֪��

�뽫���·�Ӧ���Ȼ�ѧ����ʽ����������SiO2(s)+2C(s)�TSi(s)+2CO(g) ��H=_____________
��3���ֹ辭ϵ�з�Ӧ�����ɹ���(SiH4)������ֽ����ɸߴ��裮��֪����ķֽ��¶�Զ���ڼ��飬��ԭ�ӽṹ������ԭ��________________________________��SiԪ�صķǽ���������CԪ�أ���������ȶ������ڼ��顣
��4�����ֹ�ת�����������(SiHCl3)����һ����ӦҲ���Ƶøߴ��衣
��SiHCl3�к��е�SiCl4��AsCl3�����ʶԾ�����������Ӱ�죮�����±����ݣ�����_________________�����ᴿSiHCl3��
���� | SiHCl3 | SiCl4 | AsCl3 |
�е�/�� | 32.0 | 57.5 | 131.6 |
����SiHCl3�Ʊ��ߴ���ķ�ӦΪSiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ������Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ����_____________________������ĸ��ţ���
Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ������Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ����_____________________������ĸ��ţ���
a.�÷�Ӧ��ƽ�ⳣ�����¶����߶�����
b.�������ʾ��Ͷ�ϱ�Ӧ����![]()
C.ʵ��������Ϊ���SiHCl3�������ʣ�Ӧ�ʵ������¶�
�������Ʊ����̱����ϸ������ˮ������SiHCl3��ˮ���ҷ�Ӧ����H2SiO3��HC1����һ�����ʣ�д����ƽ�Ļ�ѧ��Ӧ����ʽ��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ����
A. ����������������Һ��Ӧ��H++ OH��= H2O
B. ϡH2SO4�����۷�Ӧ��2Fe+6H+=2Fe3++ 3H2��
C. ����ͨ��ˮ�У�Cl2��H2O![]() 2H+��Cl����ClO��
2H+��Cl����ClO��
D. AlCl3��Һ�м��������İ�ˮ��Al3++ 3NH3��H2O = Al(OH)3��+3NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ͻ�8.3g����300mL2mol/L����ʱ���ڱ�״���²�������5.6L������Ӧ�����Һ�м��������ռ���Һ����ֽ��������ɳ������������Ϊ
A. 9g B. 16.8g C. 18.5g D. 22.5g
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com