
在某200mL溶液中,含MgCl2的浓度为2mol×L-1、AlCl3的浓度为3mol×L-1。若只将溶液中的Mg2+完全以Mg(OH)2的形式沉淀出来,至少应加入2mol×L-1的NaOH溶液( )
A.2L B.1.8L C.1.6L D.2.2L
科目:高中化学 来源: 题型:
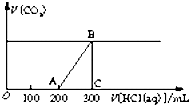 向200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.
向200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.查看答案和解析>>
科目:高中化学 来源: 题型:
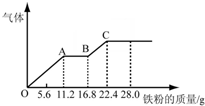 常温下,在某200mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.(设硝酸只被还原为NO气体).下列有关分析错误的是( )
常温下,在某200mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.(设硝酸只被还原为NO气体).下列有关分析错误的是( )| A、原混合酸中NO3-物质的量为0.2mol | B、原混合酸中H2SO4物质的量浓度为2mol/L | C、溶液中最终溶质为FeSO4 | D、OA段与BC段反应中电子转移的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.2L B.1.8L C.1.6L D.2.2L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com