
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度为________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是___(填字母)。

A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
【答案】Mg3(PO4)2 <10-4mol·L-1可以增大反应物的接触面积,增大反应速率Fe3+Mg(OH)2、Ca(OH)2会导致生成BaC2O4沉淀,产品产量会减少D
【解析】
(1)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Mg3(PO4)2先生成沉淀,当溶液中c(Mg2+)=10-5 mol/L时,认为镁离子完全沉淀,则溶液中的磷酸根浓度为![]() ,所以溶液中c(Ca2+)=
,所以溶液中c(Ca2+)=![]() ,即当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度<10-4mol·L-1;
,即当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度<10-4mol·L-1;
(2)①化学反应的速率与反应物的接触面积有关,毒重石用盐酸浸取前需充分研磨,可以增大反应物的接触面积,增大反应速率;
②根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.7,加入氨水,调pH为8,Fe3+完全沉淀,滤渣1为Fe(OH)3,加入氢氧化钠调节pH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2。溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,产品的产量减少;
(3)由图示可知,在该条件下,CaSO4饱和溶液中,c(Ca2+)=c(SO42-)=3.0×10-3 mol/L,Ksp(CaSO4)=9.0×10-6。向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1Na2SO4溶液后,混合液中c(Ca2+)=0.1L×3.0×103mol/L/(0.1L+0.4L)=6.0×10-4 mol/L,c(SO42-)=(0.1L×3.0×103mol/L+0.4L×0.01mol/L)/(0.1L+0.4L)=8.6×10-3 mol/L,溶液中c(Ca2+)·c(SO42-)=5.16×10-6<Ksp(CaSO4)=9.0×10-6,所以混合液中无沉淀析出,最终溶液中硫酸根离子浓度增大,答案选D。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是将Fe2+氧化为Fe3+ ,其离子方程式________________________,还可使用双氧水代替硝酸,其优点是_________________________________________。
(2)沉淀B的主要成分是_____、_______,往沉淀B中加入足量氢氧化钠溶液,现象是_________,该反应的离子方程式为____________________________________。
(3)加氨水过程需控制溶液的pH值,如何用pH试纸测定溶液的pH值___________。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:2![]() +6H++5H2C2O4=2Mn2++10CO2+8H2O。实验中称取0.800 g水泥样品,滴定时消耗了0.100 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
+6H++5H2C2O4=2Mn2++10CO2+8H2O。实验中称取0.800 g水泥样品,滴定时消耗了0.100 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列原子的半径:
原子 | N | S | O | Si |
半径r/10-10 m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,P原子的半径可能是( )
A.1.10×10-10 mB.1.08×10-10 m
C.1.20×10-10 mD.0.70×10-10 m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
B. 25℃时,NaB溶液的pH=8,c(Na+)- c(B-)=9.9×10-7 mol·L-1
C. 0.1 mol·L-1NaHCO3溶液:c(Na+)>c(oH-)>c(HCO3-)>c(H+)
D. 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。下列说法正确的是( )
硫酸 化学纯 CP 500 mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g/cm3
质量分数:98%
A. 该硫酸的物质的量浓度为9.2 mol/L
B. 1 mol Fe与足量的该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol/L的硫酸需取该硫酸50 mL
D. 等质量的水与该硫酸混合后所得溶液的物质的量浓度大于9.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。Na2CO3俗称纯碱,已知25℃时,CO32-第一步水解的平衡常数Kh=2×10-4mol/L,当溶液中c(HCO3-):c(CO32-)=20∶ 1 时,溶液的pH=______。
(2)为了除去银器表面Ag2S,可采用如下方法:在一个铝制的容器中放入食盐溶液,将银器浸入食盐溶液,使银器与铝接触良好形成原电池.过一段时间,银器表面变为银白色,并闻到臭鸡蛋的气味,观察到有少量白色絮状沉淀生成,则原电池的正极反应为______________________________,请解释臭鸡蛋气味形成的原因(用离子方程式表示)________________________________________。

(3)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=11时,溶液中的c(H2S)+c(HS-)=________mol·L-1。
②某溶液含0.040 mol·L-1M2+、0.10 mol·L-1H2S,当溶液pH=________时,Mn2+开始沉淀。[已知:Ksp(MS)=5.6×10-17]
(4)Na2S2O3溶液常作为标准液测定物质的组成。
I.取3.92 g某铁的氧化物,溶于足量稀硫酸,并配制成100.0 mL溶液;
II.取10.00 mL所得溶液,加入足量KI溶液,滴加几滴指示剂;
III.用0.2000 mol L-1的Na2S2O3标准溶液滴定,重复2~3次,平均消耗标准液20.00mL。
已知:I2+2S2O32-= S4O62-+2I-。则:
①步骤II 所用指示剂的名称为____________;判断达到滴定终点的操作和现象___________________。
②该铁的氧化物的化学式为______________。
(5)常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如上图,其中三条线代表的是A2-、H2A和HA-浓度变化的曲线,根据图示,当V(NaOH)=20 mL时,溶液中Na+、HA-、 A2-、 H2A四种微粒浓度大小关系:__________________________________。溶液显_______性。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
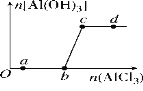
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:Ag+、Ca2+、NO3-、F-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于生物大分子的叙述中,错误的是
A. 蛋白质是以氨基酸为基本单位构成的生物大分子
B. 核酸是储存遗传信息、控制蛋白质合成的生物大分子
C. 淀粉、肝糖原、纤维素和核糖都是生物大分子
D. 多糖、蛋白质、核酸等是以碳链为骨架的生物大分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com