
| A. | 常温下,将pH=3的盐酸和pH=5的硫酸等体积混合,所得溶液的pH=4 | |
| B. | 电解质溶液导电时必将发生氧化还原反应,电解过程是将电能转化为化学能 | |
| C. | 电解氯化镁饱和溶液,可制得金属镁 | |
| D. | 铅蓄电池在放点和充电时电池内硫酸的质量分数均变小 |
分析 A.首先计算混合溶液中的c(H+),根据pH=lg[c(H+)计算];
B.在通电的条件下发生氧化还原反应是电解;
C.电解熔融的氯化镁可制得金属;
D.在充电时,电池反应中生成硫酸,则溶液中硫酸浓度不断变大.
解答 解:A.混合后c(H+)=$\frac{1{0}^{-2}+1{0}^{-4}}{2}$mol/L≈$\frac{1}{2}$×10-2mol/L,pH=2.3,故A错误;
B.电解质溶液的导电过程中,阴极得电子,阳极失电子,存在电子的转移,发生了氧化还原反应,将电能转化为化学能,故B正确;
C.电解熔融的氯化镁可制得金属,电解氯化镁溶液生成氯气、氢气和氢氧化镁,故C错误;
D.放电时,正极上电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-═PbSO4(s)+2H2O(l),负极上电极反应式为:Pb(s)+SO42-(aq)-2e-═PbSO4(s),消耗硫酸,浓度减小,充电时,阴、阳极上的电极反应式与负极、正极上电极反应式正好相反,在充电时,电池反应中生成硫酸,则溶液中硫酸浓度不断变大,硫酸的质量分数增大,故D错误.
故选B.
点评 本题考查了pH的计算、原电池和电解池原理的应用,题目难度中等,把握pH的计算方法和原电池电解池原理是关键,试题培养了学生灵活应用所学知识解决实际问题的能力.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 烯烃中的碳碳双键由l个σ键和l个π键组成 | |
| B. | 2s轨道可以和3p轨道形成sp2杂化轨道 | |
| C. | 由极性键组成的分子,一定是极性分子 | |
| D. | 甲烷中sp3杂化轨道的构型是平面正方形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠(NaCl、食盐) | B. | 氢氧化钠(NaOH、纯碱) | ||
| C. | 碳酸钠(Na2CO3、苏打) | D. | 碳酸氢钠(NaHCO3、小苏打) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、Cl-、OH- | B. | K+、Na+、Br-、NO3- | ||
| C. | H+、Fe2+、Cl2、SO42- | D. | K+、Ag+、NH3•H2O、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
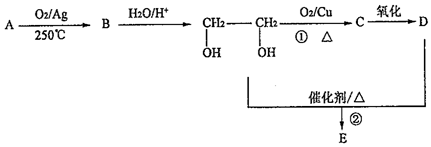
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色 | |
| B. | 苯、溴水、铁粉混合制成溴苯 | |
| C. | 沸点:戊烷>丁烷>乙烷 | |
| D. | 烷烃可以使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,CH3COOH电离增强,溶液pH减小 | |
| B. | 加入少量 NaOH 固体,平衡正向移动,c(H+ )增大 | |
| C. | 加入少量CH3COOH,平衡正向移动,CH3COOH电离增强 | |
| D. | 加入0.01mol?L-1HCl溶液,平衡不移动,但 c(CH3COO- )减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的HCl与0.1 mol/L的NH3•H2O等体积混合,溶液中的c(NH4+)>c(Cl-) | |
| B. | pH=3的HCl与pH=11的氨水等体积混合,溶液中的c(OH-)>c(H+) | |
| C. | pH=11的NaCN溶液中,由水电离出来的c(OH-)=c(H+) | |
| D. | CO2、SO2的水溶液能导电,但它们是非电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com