
| 编号 | 氨水的物质的量浓度 (mol/L) |
盐酸的物质的量浓度 (mol/L) |
混合溶液的pH |
| 第1组 | 0.1 | 0.1 | pH=X |
| 第2组 | c1 | 0.2 | pH=7 |
| 第3组 | 0.2 | 0.1 | pH>7 |
| A.0.1 mol/L 氨水的pH<13,第1组中X<7 |
| B.第2组中c1>0.2,混合后溶液中c(Cl-)=c(NH4+) |
| C.第3组混合后溶液中离子浓度由大到小的排列顺序是c(OH-)>c(Cl-)>c( NH4+ )>c (H+) |
| D.采取①加少量水、②加入少量浓盐酸、③加入少量NH4Cl固体的措施,都可以使0.1 mol/L氨水中c(NH4+)/c(NH3?H2O)增大 |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
(2011?大兴区二模)常温下,将不同浓度的氨水与盐酸等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,则下列说法不正确的是
|
查看答案和解析>>
科目:高中化学 来源:北京市大兴区2011届高三二模理综化学试题 题型:013
|
常温下,将不同浓度的氨水与盐酸等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,则下列说法不正确的是
| |
| [ ] | |
A. |
0.1 mol/L氨水的pH<13,第1组中X<7 |
B. |
第2组中c1>0.2,混合后溶液中c(Cl-)=c(NH4+) |
C. |
第3组混合后溶液中离子浓度由大到小的排列顺序是c(OH-)>c(Cl-)>c(NH4+)>c(H+) |
D. |
采取①加少量水、②加入少量浓盐酸、③加入少量NH4Cl固体的措施,都可以使 0.1 mol/L氨水中c(NH4+)/c(NH3·H2O)增大 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省深圳市直属六校高三第二次联考(2月)理综化学试卷(解析版) 题型:填空题
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)? ΔH=-235.8kJ/mol.已知2Ag2O(s)=4Ag(s)+O2(g)? ΔH=+62.2kJ/mol,则常温下反应: 2O3(g)=3O2(g)的ΔH=?????????????????????? .
(2)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为???????????????????? 。
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8。写出该反应的化学方程式为:????????????????????????
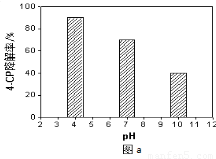 ???????????
??????????? 
(4)所得的Na2S2O8溶液可降解有机污染物4-CP。原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-·)。通过测定4-CP降解率可判断Na2S2O8溶液产生SO4-·的量。某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4-·的影响。
①溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强,???????????????? (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+。则由图示可知下列说法正确的是:_________________(填序号)
A.反应开始一段时间内, 4-CP降解率随Fe2+浓度的增大而增大,其原因是Fe2+能使Na2S2O8产生更多的SO4-·。
B.Fe2+是4-CP降解反应的催化剂
C.当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是Fe2+会与SO4—.发生反应,消耗部分SO4—.。
D.4-CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于降解反应的进行。
③当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解的平均反应速率的计算表达式为??????????????? 。
查看答案和解析>>
科目:高中化学 来源:2011年北京市大兴区高考化学二模试卷(解析版) 题型:选择题
| 编号 | 氨水的物质的量浓度 (mol/L) | 盐酸的物质的量浓度 (mol/L) | 混合溶液的pH |
| 第1组 | 0.1 | 0.1 | pH=X |
| 第2组 | c1 | 0.2 | pH=7 |
| 第3组 | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com