
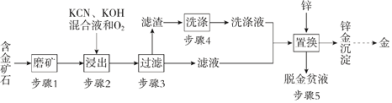
【题目】金是一种用途广泛的贵重金属。某化工厂利用氰化法从一种含金矿石中提取金的工艺流程如下:
资料:
① Zn + ![]() O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2
② Zn2+(aq) ![]() Zn(CN)2(s)
Zn(CN)2(s) ![]() Zn(CN)42-(aq)
Zn(CN)42-(aq)
(1)步骤2中发生的反应有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) H = -386.93 kJ·mol-1
则2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的H =_______。
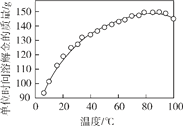
(2)下图是步骤2中金的溶解速率与温度的关系。80℃以后溶解速率降低的原因是___________。
(3)步骤4的目的是_________________。
(4)步骤5置换的总反应是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
则以下说法正确的是________(填字母序号)。
A 步骤5进行时要先脱氧,否则会增加锌的用量
B 若溶液中c(CN-)过小,会生成Zn(CN)2,减缓置换速率
C 实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN-)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。碱性条件下,用Cl2将贫液中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为_______________。
【答案】-292.27kJ·mol-1 温度太高会减小O2的溶解度,使c(O2)减小,[或温度太高会使H2O2分解,c(H2O2)减小],金的溶解速率降低 提高金的浸出率(或提高金的产率,或减小金的损失,合理即可) ABC 2CN- + 5Cl2 + 8OH- === 2CO2↑ + N2↑ + 10Cl- + 4H2O
【解析】
含金矿石经磨矿粉碎后加入KCN、KOH混合液,并通入氧气,反应生成Au(CN)2-,过滤,将滤渣洗涤,在滤液中加入Zn置换,可生成Zn、Au沉淀,加入酸除去锌,可得到金,以此解答该题。
(1)根据盖斯定律分析解答;
(5)根据题意写出反应物和生成物,结合氧化还原反应方程式的配平方法书写方程式。。
(1)①2Au(s)+4CN-(aq)+2H2O(l)+O2(g)═2Au(CN)2-(aq)+2OH-(aq)+H2O2(aq) △H=-197.61kJmol-1,②2Au(s)+4CN-(aq)+H2O2(aq)═2Au(CN)2-(aq)+2OH-(aq) △H=-386.93kJmol-1,根据盖斯定律,将![]() 可得2Au(s)+4CN-(aq)+H2O(l)+
可得2Au(s)+4CN-(aq)+H2O(l)+![]() O2(g)═2Au(CN)2-(aq)+2OH-(aq) △H=-292.27 kJmol-1,故答案为:-292.27kJmol-1;
O2(g)═2Au(CN)2-(aq)+2OH-(aq) △H=-292.27 kJmol-1,故答案为:-292.27kJmol-1;
(2)温度越高,气体在水中的溶解度越小。温度较高时,导致氧气的溶解度减小,同时也导致过氧化氢分解,使过氧化氢的浓度降低,金的溶解速率降低,故答案为:温度太高会减小O2的溶解度,使c(O2)减小[或温度太高会使H2O2分解,c(H2O2)减小],金的溶解速率降低;
(3)步骤4是洗涤沉淀,可提高金的浸出率(或提高金的产率,或减小金的损失),故答案为:提高金的浸出率(或提高金的产率,或减小金的损失);
(4)A.氧气可氧化锌,则步骤5进行时要先脱氧,否则会增加锌的用量,故A正确;B.若溶液中c(CN-)过小,会生成Zn(CN)2,Zn(CN)2为固体,难溶于水,会减缓置换速率,故B正确;C.实际生产中加入适量Pb(NO3)2,锌置换出Pb,可形成原电池,加快置换速率,故C正确;故答案为:ABC;
(5)碱性条件下,用Cl2将脱金贫液(主要含有CN-)中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为2CN-+5Cl2+8OH-═2CO2↑+N2↑+10Cl-+4H2O,故答案为:2CN-+5Cl2+8OH-═2CO2↑+N2↑+10Cl-+4H2O。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种剧毒气体,是最常用的高效熏蒸杀虫剂,也是一种电子工业原料。
(1)PH3的电子式为______________。
(2)在密闭粮仓放置的磷化铝(AlP)片剂,遇水蒸气放出PH3气体,该反应的化学方程式为:_____。
(3)PH3的一种工业制法涉及的物质转化关系如下图所示:

①次磷酸属于____元酸,亚磷酸属于____元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3) =3:1时,参加反应的n(P4):n(NaOH)= ____。
(4)一种用于处理PH3废气的吸收剂成分为次氯酸钙80%、锯木屑(疏松剂)15%、活性炭 2.5%、滑石粉(防结块)2.5%。
①次氯酸钙将PH3氧化为H3PO4的化学方程式为_______________________________;
②空气中的水蒸气可加快PH3的氧化过程,其原因可能是_______________________。
(5)从(4)中的吸收残留物中回收磷酸氢钙(CaHPO4)的方法如下:

①试剂x为_________填化学式);
②已知25℃时,H3 PO4的Kal=7.5×10-3、Ka2=6.3×10-8、Ka3 =4.4×10-13。加入Y时,应控制悬浊液pH____7(填“>”、“=”或“<”),通过计算说明理由:________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的前四周期元素,元素W是宇宙中最丰富的元素,元素X的原子最外层电子数是其内层的3倍,元素Z的基态原子核外电子有24种运动状态,Y、X、Z不在同一周期,且Y原子核外p电子比s电子多5个。
(1)Z基态原子的核外电子排布式为__________。
(2)Z的氧化物是石油化工中重要的催化剂之一,如催化异丙苯(![]() )裂化生成苯和丙烯。
)裂化生成苯和丙烯。
①1mol丙烯分子中含有σ键与π键数目之比为_______。
②苯分子中碳原子轨道的杂化类型为__________。
③Z的一种氧化物ZO5中,Z的化合价为+6,则其中过氧键的数目为_______个。
(3)W、X、Y三种元素的电负性由小到大顺序为__________。(请用元素符号回答)
(4)ZY3熔点为1152℃,熔融状态下能够导电,据此可判断ZY3晶体属于__________(填晶体类型)。
(5)ZX2晶体的晶胞结构如图,每个Z原子周围最近的X 原子数目为__________。若该化合物的相对分子质量为M,晶胞边长为acm,阿伏加德罗常数为NA,则该晶体的密度为_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸普鲁卡因 ( 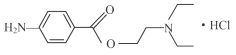 ) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:
) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:

回答下列问题:
(1) 3molA可以合成1molB, 且B是平面正六边形结构, 则B的结构简式为_________。
(2) 有机物C的名称为____________, B→C的反应类型为_____________。
(3) 反应C→D的化学方程式为________________________________________。
(4) F和E发生酯化反应生成G, 则F的结构简式为___________________。
(5) H的分子式为____。
(6) 分子式为C9H12且是C的同系物的同分异构体共有__________种。
(7) 请结合上述流程信息, 设计由苯、 乙炔为原料合成 的路线_______________ 。(其他无机试剂任选)
的路线_______________ 。(其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。如图用该水激活电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是

A. II为正极,其反应式为Ag+ + e– =Ag
B. 水激活电池内Cl–由正极向负极迁移
C. 每转移1 mole-,U型管中消耗0. 5mol H2O
D. 开始时U型管中Y极附近pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用AG表示溶液酸度:![]() 。在室温下,用 0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
。在室温下,用 0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是

A. 0.1molL-1的CH3 COOH溶液的pH=3.4
B. A点加入的NaOH溶液的体积为20.00mL
C. 滴定过程中,c(CH3COO-)/c(H+)逐渐减小
D. B点溶液中可能存在c(Na+)>c(CH3COO-)> c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置能达到实验目的的是
A.  分离CH3COOH和CH3COOC2H5混合液
分离CH3COOH和CH3COOC2H5混合液
B.  验证NH4NO3晶体溶于水的热效应
验证NH4NO3晶体溶于水的热效应
C.  蒸发FeCl3溶液得到FeCl3固体
蒸发FeCl3溶液得到FeCl3固体
D. 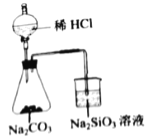 验证C、Cl、Si的非金属性强弱
验证C、Cl、Si的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是

A. 该装置工作时,化学能转变为电能
B. CuCl2能将C2H4还原为 l , 2-二氯乙烷
C. X、Y依次为阳离子交换膜、阴离子交换膜
D. 该装置总反应为CH2CH2 + 2H2O + 2NaCl![]() H2 + 2NaOH + ClCH2CH2Cl
H2 + 2NaOH + ClCH2CH2Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com