
下列各组物质中,不管它们以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳的量不变的是
A.乙烯(C2H4)和苯(C6H6) B.乙醇和丙醇(CH3CH2CH2OH)
C.乙醇和乙醚(C2H5OC2H5) D.甲醛( HCHO)和乙酸
科目:高中化学 来源:2016届山东省新高三开学初模拟检测化学试卷(解析版) 题型:填空题
(10分)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将 (填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500 s内N2O5的分解速率为 。
③在T2温度下,反应1000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1(填>、<或=)。
(3)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2。
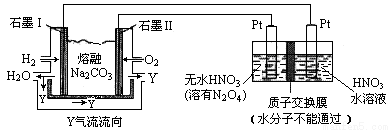
写出石墨Ⅰ电极上发生反应的电极反应式 ,N2O5在电解池的 区生成(填“阳极”或“阴极”)。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期第一次质检化学试卷(解析版) 题型:选择题
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为
A.1∶6 B.1∶7 C.2∶11 D.16∶25
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三第一次月考化学试卷(解析版) 题型:选择题
(改编)下列化学实验事实及其结论都正确的是
选项 | 实验事实 | 结论 |
A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
C | 将水蒸气通过灼热的铁粉,粉末变红 | 铁与水在高温下发生反应 |
D | 将铜丝插入浓硫酸中加热,有气泡冒出 | Cu与浓硫酸发生置换反应 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省忻州市高一上入学化学试卷(解析版) 题型:选择题
将一定量的铁粉加入到一定量的硝酸银和硝酸镁的混合液中,充分反应后过滤,向滤渣中加入稀硫酸,有气泡产生,则在滤渣中
A.一定有银、铁和镁 B.仅有银和铁
C.可能含镁 D.只有银
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三9月调考化学试卷(解析版) 题型:选择题
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:

已知转化过程中的反应为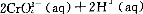
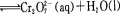
转化后所得溶液中铬元素的含量为28.6 g/L, CrO42-有10/11转化为Cr2072-,下列说法不正确的是
A.溶液颜色保持不变,说明上述可逆反应达到平衡状态
B.若用绿矾(FeS04·7H2O)作还原剂,处理1 L废水,至少需要458.7g
C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D.常温下Ksp=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上第三次月考化学试卷(解析版) 题型:计算题
按要求回答下列问题:
(1)设NA为阿伏加德罗常数,一个Cl2分子的质量为 g;水煤气(CO 和H2的混合物)中含氢气的体积分数约为75%、CO的体积分数约为25%,则该水煤气的平均摩尔质量约为 。
(2)质量分数为29.8%的KCl溶液,其密度为1.15g/cm3,则500mL该溶液中KCl的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上第三次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.光导纤维的主要成分是硅 B.水晶项链是硅单质制品
C.利用盐酸刻蚀石英制作艺术品 D.硅酸钠是制备木材防火剂的原料
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期第四次月考化学试卷(解析版) 题型:填空题
(Ⅰ)某温度下,NaCl溶液中的c(H+)=2.0×10-7 mol/L,则此时在溶液中:
(1)由水电离产生的c(OH-)= ;
(2)若温度不变,滴入稀硫酸使c(H+)=5.0×10-6 mol/L,则c(OH-)= 。
(Ⅱ)(3)某温度下水的离子积为KW =1×10-13,则该温度(填“大于”、“等于”或“小于”)
25℃。
若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过填写以下不同情况时两种溶液的体积比:
(4)若所得混合液为中性,则a∶b= ;
(5)若所得混合液的pH=2,则a∶b= ;
(6)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,若测定结果偏高,其原因可能是 。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com