
| A. | 在晶体中只要有阳离子就一定有阴离子 | |
| B. | .离子晶体中只有离子键没有共价键,分子晶体中只有分子间作用力没有共价键 | |
| C. | .分子晶体中分子间作用力越大,分子越稳定 | |
| D. | .原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
分析 A.金属晶体是由金属阳离子和自由电子构成的;
B.离子晶体中一定存在离子键,可能有共价键,分子晶体中有分子间作用力,可能有共价键,多数分子晶体有;
C.分子间作用力与分子稳定性无关;
D.原子晶体的物理性质由共价键决定.
解答 解:A.金属晶体是由金属阳离子和自由电子构成的,所以晶体中有阳离子不一定存在阴离子,故A错误;
B.离子晶体中一定存在离子键,可能有共价键,如NaOH中既有离子键又有共价键,分子晶体中肯定有分子间作用力,大多数有共价键,少数没有如稀有气体,故B错误;
C.分子的稳定性属于化学性质,与共价键有关,分子间作用力与稳定性无关,故C错误;
D.原子晶体中原子以共价键结合,共价键的键能较大,所以原子晶体的熔点高、硬度大,故D正确;
故选D.
点评 本题考查了化学键、分子间作用力、晶体等知识,题目难度不大,侧重于基础知识的考查,注意相关基础知识的积累.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO属于共价化合物 | |
| B. | ClO-与Ca2+、Fe2+、Al3+ 能大量共存 | |
| C. | 1L 0.1mol?L-1NaClO溶液中ClO-的数目为0.1NA | |
| D. | “84”消毒液在空气中久置变质发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳分子的结构式:O-C-O | |
| B. | 氢氧根离子的电子式: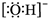 | |
| C. | 氯原子的结构示意图: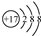 | |
| D. | 中子数为146、质子数为92 的铀(U)原子${\;}_{92}^{146}$U |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
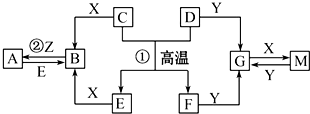
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com