
| A. | 3 mL | B. | 7.5 mL | C. | 15 mL | D. | 22.5 mL |
分析 n(AlCl3)=0.03 mol,n[Al(OH)3]=0.01 mol,由沉淀的物质的量小于氯化铝的物质的量可推知此题可能有两个答案:一是氢氧化钠不足,二是氢氧化钠过量,据此分析解答.
解答 解:n(AlCl3)=0.03 mol,n[Al(OH)3]=0.01 mol,由沉淀的物质的量小于氯化铝的物质的量可推知此题可能有两个答案:一是氢氧化钠不足,二是氢氧化钠过量;
由两者反应的离子方程式知Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O知,
当碱的量不足时,只发生反应Al3++3OH-═Al(OH)3↓,根据氢氧化铝和氢氧根离子之间的关系式得,则V(NaOH)=$\frac{\frac{0.78g}{78g/mol}×3}{4mol/L}$=7.5 mL;
当碱过量时,生成氢氧化铝发生的反应为Al3++3OH-═Al(OH)3↓,根据氢氧化铝和氢氧根离子之间的关系式得,则V(NaOH)=$\frac{\frac{0.78g}{78g/mol}×3}{4mol/L}$=7.5 mL;
根据铝离子守恒得n(AlO2-)=0.03mol-0.01mol=0.02mol,发生的反应为Al3++4OH-═AlO2-+2H2O,根据方程式知,生成偏铝酸根离子需要氢氧化钠体积=$\frac{0.02mol×4}{4mol/L}$=20mL,
所以一共需要氢氧化钠体积为:7.5mL+20mL=27.5mL,
故选B.
点评 本题考查了物质的量的有关计算,题目难度中等,明确氯化铝和氢氧化钠之间的反应是解本题关键,注意要分情况讨论,很多同学往往漏掉氢氧化钠溶液和氢氧化铝的反应而导致错误,为易错题.


科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中,加入1.5mol H2和0.5mol N 2充分反应后,可得到NH3分子数为NA | |
| B. | 常温下,pH=2的醋酸溶液中所含H+的数目为0.01NA | |
| C. | 1L 0.1mol•L-1 AlCl3的溶液中所含Al3+的数目为0.1NA | |
| D. | 精炼铜时,阴极质量增加6.4g,则电路中转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中转移电子为0.04 mol | B. | Q中n(Cu2+):n(Fe2+)=1:2 | ||
| C. | 溶液Q比原溶液增重了 1.28 g | D. | 3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 固体质量 | 加入某浓度盐酸的体积/mL | 加入某浓度NaOH的体积/mL | 收集到气体体积/mL |
| 1 | 0.9 | 20.0 | ─ | 1008 |
| 2 | 0.9 | 30.0 | ─ | 1008 |
| 3 | 0.9 | ─ | 20.0 | 672 |
| 4 | 0.9 | ─ | 30.0 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知ag乙烯气体充分燃烧时生成1molCO2和液态水,放出bkJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=-4b kJ•mol-1 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270kJ•mol-1,则1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量数值小于270kJ | |
| C. | 常温常压下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0kJ•mol-1 则C(s,金刚石)═C(s,石墨)△H=-1.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 255 | 385 | 459 |
| 标准状况下气体的体积(mL) | 280 | 336 | 336 |
| A. | 甲、乙组的实验中,盐酸均是过量的 | B. | 盐酸的物质的量浓度为0.8mol L-1 | ||
| C. | 合金中镁、铝的物质的量之比为1:1 | D. | 丙组中铝的物质的量为0.0045mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 气体 | CO2 | HCl | HCl | SO2 |
| 液体 | H2O | NaOH | H2O | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
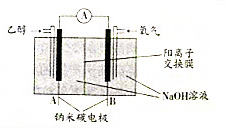
| A. | A极为电池负极,B极为电池正极 | |
| B. | B极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 该乙醇燃料电池的总反应方程式为:C2H5OH+3O2═2CO2+3H2O | |
| D. | 当电池消耗4.6g乙醇时,经过阴离子交换膜的OH-为1.2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com