
将一定量的CO2缓慢地通入500ml NaOH溶液中,充分反应后将溶液低温蒸发,得到不含结晶水的白色固体A 9.50g。取3份质量不同的A,分别与100ml相同物质的量浓度的盐酸反应,得到的气体体积(标准状况)与A的质量关系如下表所示:( )
|
组别 |
I |
II |
III |
|
盐酸体积/ml |
100 |
100 |
100 |
|
A的质量/g |
1.90 |
3.42 |
3.80 |
|
气体的体积/ml |
448 |
716.8 |
672 |
下列说法不正确的是
A.第I组样品盐酸有剩余
B.若加入0.38g样品,则最终放出气体67.2mL
C.原NaOH的物质的量浓度是0.3mol·L—1
D.盐酸的物质的量浓度的0.5mol/L
科目:高中化学 来源:2013届河北省冀州中学高三一轮检测化学试卷(带解析) 题型:单选题
将一定量的CO2缓慢地通入500ml NaOH溶液中,充分反应后将溶液低温蒸发,得到不含结晶水的白色固体A 9.50g。取3份质量不同的A,分别与100ml相同物质的量浓度的盐酸反应,得到的气体体积(标准状况)与A的质量关系如下表所示:( )
| 组别 | I | II | III |
| 盐酸体积/ml | 100 | 100 | 100 |
| A的质量/g | 1.90 | 3.42 | 3.80 |
| 气体的体积/ml | 448 | 716.8 | 672 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省黄冈市高三上学期期末考试理综化学试卷(解析版) 题型:实验题
某实验小组为研究草酸的制取和草酸的性质,进行如下实验。
实验I:制备草酸
实验室用硝酸氧化淀粉水解液制备草酸的装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
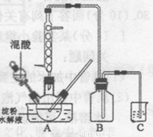
①将一定量的淀粉水解液加人三颈瓶中
②控制反应液温度在55〜600C条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸 (65%HNO3与98%H2S04的质量比为2 :1.5)溶液
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2↑+8NO↑+10H2O
3 H2C2O4+2HNO3→6CO2↑+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为________。
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是________。
实验II :草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4 • xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100.0mL的水溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0. 5mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL。回答下列问题:
(3)写出上述反应的离子方程式________________。
(4)计算x=________。
(5)滴定时,常发现反应速率开始很慢,后来逐渐加快,可能的原因是________。
实验III:草酸不稳定性
查阅资料:草酸晶体(H2C2O4 •xH20),1000C开始失水,100.5℃左右分解产生H2O、CO和CO2。请用下图中提供的仪器及试剂,设计一个实验,证明草酸晶体分解得到的混合气中有H2O、CO和CO2 (加热装置和导管等在图中略去,部分装置可重复使用)。
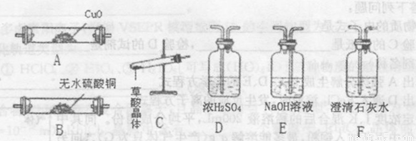
回答下列问题:
(6)仪器装置按连接顺序为________。
(7)仪器B中无水硫酸铜的作用________。
(8)能证明混合气中含有CO的实验依据是________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省高三秋季期中联考化学试卷(解析版) 题型:填空题
(8分)(1)已知20oC时的溶解度:Na2CO3:S=21.2g; NaHCO3:S=9.6g。则20oC恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出NaHCO3__________g(小数点后保留1位)
(2)向500mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入CO2气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为______mol/L。
(3)将一定质量的钠加入到89g水中,完全反应后的溶液为100g,则该溶液的质量分数为________。
(4)现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
①取440ml甲与120ml乙反应,产生1.56g沉淀;
②取440ml乙与120ml甲反应,也产生1.56g沉淀;
③取120ml甲溶液与400ml乙溶液反应,则产生3.12g沉淀;通过必要的计算和推理判定:
甲溶液为 溶液,乙溶液为 溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
| 组别 | I | II | III |
| 盐酸体积/ml | 100 | 100 | 100 |
| A的质量/g | 1.90 | 3.42 | 3.80 |
| 气体的体积/ml | 448 | 716.8 | 672 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com