
���� ��1��������ӦMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O�����й������㣬���ݲ����������ʼ����������������ʵ������ٸ���2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O�������ɴ�����Ƶ�������
��2������Ŀ��Ϣ��֪�����ŷ�Ӧ���У��¶����ߣ������������Ca��ClO3��2��Cl2δ��ʯ������ȫ��Ӧ������ʵ�ʴ����������С������ֵ��
��� �⣺��1��n��HCl��=12mol/L��0.2L=2.4 mol��n��MnO2��=17.4g��87g/mol=0.2 mol��������Ӧ��MnO2+4 HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O������n��MnO2����n��HCl��=2.4 mol��0.2 mol=12��1��4��1 ����ŨHCl�����������ɵ�n��Cl2��=n��MnO2��=0.2 mol���ٸ���2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O����֪���ɴ������Ϊ0.2mol��$\frac{1}{2}$=0.1mol��������Ƶ�����Ϊ0.1mol��143g/mol=14.3g��
�����������Ƶ�Ca��ClO��2Ϊ14.3�ˣ�
��2������Ŀ��Ϣ��֪�������ŷ�Ӧ���У��¶����ߣ������������Ca��ClO3��2����Ӧ����ʽΪ��6Cl2+6Ca��OH��2$\frac{\underline{\;\;��\;\;}}{\;}$5CaCl2+Ca��ClO3��2+6H2O����Cl2δ��ʯ������ȫ��Ӧ������������NaOH��Һ���գ���Ӧ����ʽΪ��Cl2+2NaOH=NaCl+NaClO+H2O������ʵ�ʴ����������С������ֵ��
�𣺢����ŷ�Ӧ���У��¶����ߣ������������Ca��ClO3��2����Cl2δ��ʯ������ȫ��Ӧ������������NaOH��Һ���գ�
���� ���⿼�黯ѧ����ʽ�йؼ��㣬���ؿ���ѧ������Ϣ��ȡ��֪ʶǨ�����ã���Ҫѧ���߱���ʵ�Ļ������Ѷ��еȣ�


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
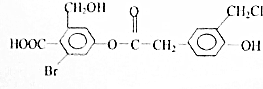 �л���N�Ľṹ��ͼ��ʾ��1mol�л���N��һ�������·ֱ�������NaOH����Һ����NaHCO3����Һ����H2��Ӧ������������3�����ʵ����ʵ���֮��Ϊ��������
�л���N�Ľṹ��ͼ��ʾ��1mol�л���N��һ�������·ֱ�������NaOH����Һ����NaHCO3����Һ����H2��Ӧ������������3�����ʵ����ʵ���֮��Ϊ��������| A�� | 8��1��7 | B�� | 5��1��6 | C�� | 5��2��6 | D�� | 7��1��6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4+��CH3COO-��Ca2+��Cl- | B�� | Fe3+��Ag+��SO42-��NO3- | ||
| C�� | Cu2+��H+��S2-��NO3- | D�� | SCN-��Fe3+��K+��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����� | B�� | Ũ���� | C�� | ��ˮ | D�� | �⻯������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
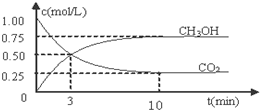
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ��ʾװ�ÿ�������ȡ�۲�Fe��OH��2�ڿ����б�����ʱ��ɫ�ı仯��ʵ��ʱ����ʹ����м��6mol/L�����ᣬ�����Լ���ѡ����д���пհף�
��ͼ��ʾװ�ÿ�������ȡ�۲�Fe��OH��2�ڿ����б�����ʱ��ɫ�ı仯��ʵ��ʱ����ʹ����м��6mol/L�����ᣬ�����Լ���ѡ����д���пհף��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
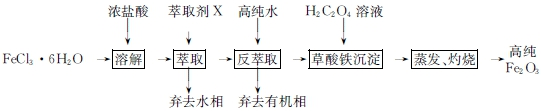
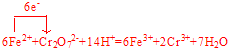 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
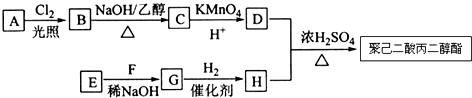
 ��
�� ��
��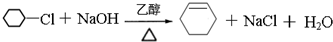 ��
��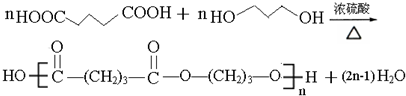 ��
��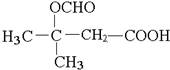 ��д������һ�ֽṹ��ʽ����
��д������һ�ֽṹ��ʽ����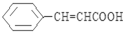 ���ĺϳ�·��ʾ��ͼ��
���ĺϳ�·��ʾ��ͼ��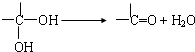
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �屽 | B�� | ���� | C�� | ������ | D�� | ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com