
 在t℃时,Ag2CrO4(橘红色) 在水溶液中沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
在t℃时,Ag2CrO4(橘红色) 在水溶液中沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )| A. | 将AgNO3溶液滴加到KCl溶液中,反应的活化能几乎为零 | |
| B. | t℃时,Ag2CrO4的Ksp=1×10-8 | |
| C. | 饱和Ag2CrO4溶液中,加入水能使溶液由X点变为Y点 | |
| D. | t℃时,AgCl比Ag2CrO4的溶解度大 |
分析 A.将AgNO3溶液滴加到KCl溶液中,反应立即产生AgCl沉淀,反应迅速,不存在能量障碍;
B.根据图象,t℃时,溶液中存在c(Ag+)=1×10-3mol/L,$c(Cr{O}_{4}^{2-})$=1×10-5mol/L时,可计算Ag2CrO4的Ksp;
C.饱和Ag2CrO4溶液中,存在沉淀溶解平衡,则有J=Ksp,加入水稀释,能使化学平衡向正反应方向移动,则有J<Ksp,图象上Z点含义为J=Ksp,X点含义为J>Ksp,据此判断;
D.t℃时,比较相同量情况下AgCl和Ag2CrO4的Ksp,可以比较二者的溶解度大小.
解答 解:A.将AgNO3溶液滴加到KCl溶液中,反应立即产生AgCl沉淀,反应迅速,可判断不存在能量障碍,因此反应的活化能几乎为零.故A正确.
B.根据图象,t℃时,溶液中存在c(Ag+)=1×10-3mol/L,$c(Cr{O}_{4}^{2-})$=1×10-5mol/L时,Ag2CrO4的Ksp=${c}^{2}(A{g}^{+})•c(Cr{O}_{4}^{2-})$=(1×10-3)2×(1×10-5)=1×10-11.故B错误.
C.饱和Ag2CrO4溶液中,存在沉淀溶解平衡:Ag2CrO4(s)?2Ag+(aq)+$Cr{O}_{4}^{2-}(aq)$,记反应的浓度积为J,则图象上Z点的含义即为J=Ksp,加水能使得化学平衡向正反应方向移动,则此时应为J<Ksp,图象上X点的含义为J>Ksp,综上,加入水,不能使溶液由X点变为Z点.故C错误.
D.t℃时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1×10-11,则相同情况下,AgCl比Ag2CrO4的溶解度大,这里并没有说明是相同情况下.故D错误.
故选A.
点评 本题考查沉淀溶解平衡的知识,结合图象分析,灵活运用浓度积与溶度积来判断化学反应的方向是解题的关键.题目难度不大,是基础题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
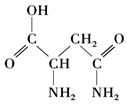 芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 高温煅烧石灰石 | |
| B. | 氧化钙与水反应 | |
| C. | 氢气还原氧化铜 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl固体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向纯水中加入少量固体碳酸钠,c(H+)减小,Kw不变,促进水的电离 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,变小 | |
| C. | 将纯水加热到95℃时,变大,pH不变,水仍呈中性 | |
| D. | 向水中加入A1C13固体,平衡正向移动,c(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2溶于水得到NaOH,所以Na2O2为碱性氧化物 | |
| B. | NaHSO4溶液、Na2CO3溶液分别呈酸性、碱性,则NaHSO4属于酸,Na2CO3属于碱 | |
| C. | HCl、NH3的水溶液都能导电,则HCl、NH3均属于电解质 | |
| D. | 用一束光照射稀豆浆时产生丁达尔效应,则稀豆浆属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
| A. | 当容器中气体的密度不变时,该反应达到平衡状态 | |
| B. | 若要提高SO2的转化率,可用空气代替纯氧气并鼓入过量空气 | |
| C. | 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L•min) | |
| D. | 容器内达到平衡状态时的压强与起始时的压强之比为5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属性强弱:I>Br>Cl | B. | 原子半径大小:Na>P>S | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com