
分析 在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.Ag+:加入过量的铁粉,使Ag+还原为Ag,将混有Fe粉的Ag用稀H2SO4处理,使Fe溶解,过滤,分离出银,据此分析解答.
解答 解:(2)要从工业废水中回收金属银和硫酸亚铁,根据铁能将银离子置换出来的性质,加入过量的铁粉,使银全部被置换出来,故答案为:使Ag+还原为金属银;
(3)过滤得到银和铁的混合物,将银和过量铁粉从溶液中分离出来,故答案为:将银和过量铁粉从溶液中分离出来;
(4)根据铁可以和酸发生置换反应而银不与酸发生置换反应的性质,将得到的固体混合物加入稀硫酸,使铁反应,过滤得到银,故答案为:使铁粉溶解;
(5)将得到的固体混合物加入稀硫酸,使铁反应,过滤得到银,故答案为:分离出银;
(6)最后将溶液混合,根据物质溶解度的不同,加热得到饱和溶液,然后降温使硫酸亚铁晶体析出,然后加热使硫酸亚铁晶体失去结晶水从而得到硫酸亚铁,故答案为:使硫酸亚铁结晶析出.
点评 本题考查了混合物的分离和提纯的实验方案的设计,完成此题,可以依据金属活动性顺序及其意义进行,题目难度不大.


科目:高中化学 来源: 题型:解答题
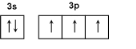 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲基中含电子数目为10NA | |
| B. | 标准状况下,11.2L己烷所含有的分子数为0.5NA | |
| C. | 14g乙烯和丁烯的混合物中含有的原子总数为3NA个 | |
| D. | 常温下,4gCH4含有2NA个C-H共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验操作 | 实验现象与结论 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
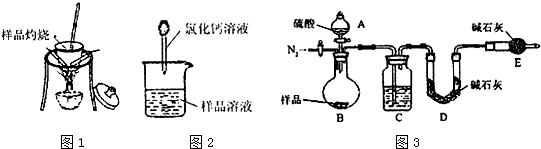
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
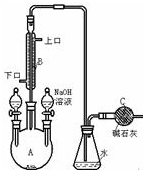 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 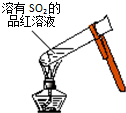 加热后溶液颜色变为无色 加热后溶液颜色变为无色 | |
| B. | 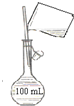 配制100 mL 0.10 mol•L-1NaCl溶液 配制100 mL 0.10 mol•L-1NaCl溶液 | |
| C. | 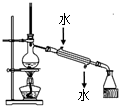 实验室用该装置制取少量蒸馏水 实验室用该装置制取少量蒸馏水 | |
| D. | 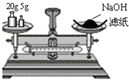 称量25 g NaOH 称量25 g NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com