
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | B. | c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-) | ||
| C. | c(Na+)=c(HRO3-)+(H2RO3)+2c(RO32-) | D. | 以上都不正确 |
分析 NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,NaHCO3溶液呈碱性,说明HCO3-水解沉淀大于电离程度,
两溶液中发生的过程相似,①溶质电离:NaHRO3=Na++HRO3-,②HRO3-电离:HRO3-?H++RO32-,③HRO3-水解:HRO3-+H2O?H2RO3+OH-,④水电离:H2O?H++OH-;
由溶液呈电中性有电荷守恒关系(a):c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-);
据化学式NaHRO3得物料守恒关系(b):c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3);
(a)-(b)得质子守恒关系(c):c(H+)+c(H2RO3)=c(RO32-)+c(OH-);
对NaHSO3溶液,过程②的程度大于③,有c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
对NaHCO3溶液,过程③的程度大于②,有c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+);
同浓度的两溶液中,c(Na+)相等,c(HRO3-)不一定相等,c(SO32-)>c(CO32-).
解答 解:A.NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,c(H+)>c(OH-),NaHCO3溶液呈碱性,说明HCO3-水解沉淀大于电离程度,c(OH-)>c(H+),故A错误;
B.由溶液呈电中性有电荷守恒关系:c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),故B错误;
C.根据化学式NaHRO3得物料守恒关系:c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),故C错误;
D.分析可知以上都不正确,故D正确;
故选D.
点评 本题考查离子浓度的大小比较,题目难度中等,解答本题时注意从守恒的角度分析,本题中还要注意题目要求,即浓度均为浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液中均存在的关系,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
 (1)氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取sp3杂化,NH4+中HNH键角比NH3中HNH键角大,原因是氨气分子中氮原子上有一对孤对电子,铵根离子中氮原子上没有孤对电子,排斥力小.
(1)氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取sp3杂化,NH4+中HNH键角比NH3中HNH键角大,原因是氨气分子中氮原子上有一对孤对电子,铵根离子中氮原子上没有孤对电子,排斥力小.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-的结构示意图: | B. | 羰基硫(COS)的电子式: | ||
| C. | CO2的分子模型示意图: | D. | HClO的结构式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 血栓病人可以直接吸取一氧化氮治病 | |
| B. | 等物质的量的一氧化氮与一氧化碳的体积相同 | |
| C. | 常温常压下,一氧化氮能与空气中的氧气直接化合 | |
| D. | 一氧化氮易溶于水,不能用排水法收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
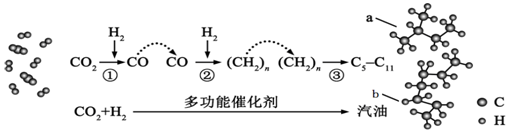
| A. | 物质a和b是同系物 | B. | 反应②中只有碳碳键形成 | ||
| C. | 汽油主要是C5~C11的烃类混合物 | D. | 图中b的名称是辛烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2v(NH3)=v (CO2) | |
| B. | 密闭容器中气体的平均摩尔质量不变 | |
| C. | 密闭容器中混合气体的密度不变 | |
| D. | 密闭容器中氨气的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a | |
| B. | 电极b是正极,O2-由电极b流向电极a | |
| C. | 电极a的反应式为:CH4+5O2--8e-=CO32-+2H2O | |
| D. | 当固体电解质中有1 mol O2-通过时,电子转移4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2Q1+Q2>4Q3 | B. | 2Q1+Q2<4Q3 | C. | Q1+Q2>4Q3 | D. | Q1+$\frac{1}{2}$Q2=2Q3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com