
【题目】VIA族的氧,硫,硒(Se),碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______。
![]()
(2)Se原子序数为______,其核外M层电子的排布式为______。
(3)H2Se的酸性比H2S__________(填“强”或“弱”)。气态SeO3分子的立体构型为______,SO32-离子的立体构型为______。
(4)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:__________。
②H2SeO4比H2SeO3酸性强的原因:________________________。
【答案】sp3 34 3s23p63d10 强 平面正三角形 三角锥型 酸第一步电离产生的酸根阴离子带有负电荷,吸引H+ H2SeO4和H2SeO3可以分别表示为(HO)2SeO2,(HO)2SeO,H2SeO4中Se为+6价,而H2SeO3中Se为+4价,前者含有较多的非羟基O原子,故Se原子吸电子能力强,导致羟基上氢原子更容易电离H+
【解析】
(1)根据图片知,每个S原子含有2个σ键和2个孤电子对,所以每个S原子的价层电子对个数是4,则S原子为sp3杂化;
(2)Se元素34号元素,M电子层上有18个电子,分别位于3s、3p、3d能级上,所以其核外M层电子的排布式为3s23p63d10;
(3)非金属性越强的元素,其与氢元素的结合能力越强,则其氢化物在水溶液中就越难电离,酸性就越弱,非金属性S>Se,所以H2Se的酸性比H2S强,气态SeO3分子中Se原子价层电子对个数是3且不含孤电子对,所以其立体构型为平面正三角形,SO32-离子中S原子价层电子对个数=3+![]() (6+2-3×2)=4,且含有一个孤电子对,所以其立体构型为三角锥形;
(6+2-3×2)=4,且含有一个孤电子对,所以其立体构型为三角锥形;
(4)①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,所以H2SeO4和H2SeO3第一步电离程度大于第二部电离程度;
②H2SeO4和H2SeO3可以分别表示为(HO)2SeO2,(HO)2SeO,H2SeO4中Se为+6价,而H2SeO3中Se为+4价。前者含有较多的非羟基O原子,故Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硒是人体必需的微量元素,右图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种化合物的溶解度随温度变化曲线如图所示,下列说法正确的是( )
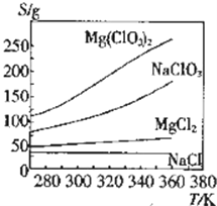
A.NaClO3的溶解是放热过程
B.由图中数据可求出300K时MgCl2饱和溶液的物质的量浓度
C.可采用复分解反应制备Mg(ClO3)2:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl
D.若NaCl中含有少量Mg(ClO3)2,可用降温结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式,正确的是( )
A. 稀硝酸和过量的铁屑反应:Fe+4H++ NO3-= Fe3++NO↑+2H2O
B. NH4HCO3溶液与少量的NaOH溶液混合:HCO3-+OH- = CO32-+H2O
C. 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+= Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL 0.1molL-1 NaOH溶液中逐滴加入0.2molL-1 CH3COOH溶液,曲线如图所示,下列判断正确的是( )

A. B点,a=12.5
B. D点,c(Na+)=c(CH3COO-)+c(CH3COOH)
C. 在C点升温,CH3COOH电离程度增大,CH3COO-的水解程度减小
D. 在A、B间存在一点,此点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
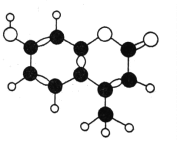
①分子式为C10H9O3 ②不能溶于水 ③1mol该物质最多能与4molH2加成 ④能使酸性KMnO4溶液褪色 ⑤1mol该物质最多能与含2mol NaOH的溶液反应
A. ①②③B. ③④⑤C. ②③④D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
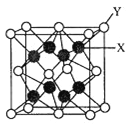
(1)E在同期表中的位置是_______,其基态原子的简化电子排布式为____________。
(2)CB![]() 的立体构型是______。
的立体构型是______。
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为____(填离子符号);D2C的熔点比CaF2熔点__________________(填“高”、“低”或“无法比较”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大B. 平衡向正反应方向移动
C. D的体积分数变大D. a<c+d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com