
| A. | 人类目前所直接利用的能量全部是由化学反应产生的 | |
| B. | 化学反应不一定伴随着能量变化 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物质量的多少无关 |
分析 人类目前所直接利用的能量可为太阳能等、也可由化学反应产生,与热能等,化学反应的实质为旧键的断裂和新键的形成,断裂化学键吸收能量,形成化学键放出能量,则化学一定伴随能量变化,参加反应的物质的物质的量越多,能量变化越多,以此解答该题.
解答 解:A.人类目前所直接利用的能量不一定全部是由化学反应产生的,如太阳能,故A错误;
B.化学反应的实质为旧键的断裂和新键的形成,断裂化学键吸收能量,形成化学键放出能量,则化学一定伴随能量变化,故B错误;
C.由B分析可知,化学变化中的能量变化主要是由化学键变化引起的,故C正确;
D.参加反应的物质的物质的量越多,能量变化越多,故D错误.
故选C.
点评 本题考查化学反应与能量变化,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,注意生活中的能源及与人类活动有关的能量变化题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 正常雨水pH等于7,酸雨的PH小于7 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性小于碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
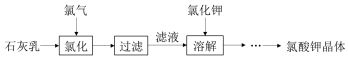
| 加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | c | d | e | e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
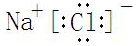 ,反应中被氧化的物质是Fe(OH)3(写化学式).
,反应中被氧化的物质是Fe(OH)3(写化学式).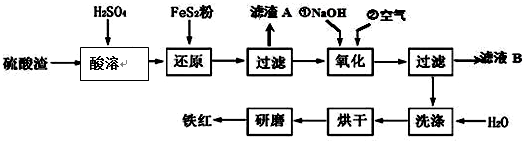
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与15N有相同的中子数 | B. | 13C与12C性质相同 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀盐酸反应 | B. | 灼热的炭与水蒸气的反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氘(D2)气体,含有中子数为2NA | |
| B. | 1.6gNH2-离子所含电子数为NA | |
| C. | 4g氦气所含分子数为0.5NA | |
| D. | NA个SO3分子在标准状况下的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
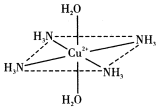 往硫酸铜水溶液中加入氨水,首先生成难溶物,继续加氨水,难溶物溶解,而且所得溶液的颜色比原来明显加深,得到了一种含2+的溶液,此离子的立体结构如图所示(4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直).请回答以下问题:
往硫酸铜水溶液中加入氨水,首先生成难溶物,继续加氨水,难溶物溶解,而且所得溶液的颜色比原来明显加深,得到了一种含2+的溶液,此离子的立体结构如图所示(4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直).请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com