
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)

化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ____。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn__________g。(已经F=96500C/mol)
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,加碱调节至pH为___________时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_________时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是_________。
【答案】MnO2+e-+H+=MnOOH 0.05 2.7 6 Zn2+和Fe2+分离不开
【解析】
(1)该电池负极锌被氧化生成Zn2+,正极发生还原反应,MnO2被还原生成MnOOH;
(2)持电流强度为0.5A,电池工作五分钟,则电量为0.5A×300s=150C,转移电子的物质的量为150C÷96500C·mol-1,以此计算消耗锌的质量、物质的量;
(3)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol·L-1,结合Ksp=10-39计算pH,并根据Ksp计算锌开始沉淀的pH.
Zn(OH)2和 Fe(OH)2的Ksp相近,同时沉淀。
(1)该电池负极锌被氧化生成Zn2+,正极发生还原反应,MnO2被还原生成MnOOH,电极方程式为MnO2+H++e-=MnOOH;
(2)持电流强度为0.5A,电池工作五分钟,则电量为0.5A×300s=150C,转移电子的物质的量为150C÷96500C·mol-1,则消耗Zn的质量为![]() ×65g·mol-1=0.05g;
×65g·mol-1=0.05g;
(3)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol·L-1,因Ksp=10-39,则c(OH-)=![]() mol·L-1≈0.5×10-11mol·L-1,此时pH=2.7;如锌开始沉淀,则c(OH-)=
mol·L-1≈0.5×10-11mol·L-1,此时pH=2.7;如锌开始沉淀,则c(OH-)=![]() mol·L-1=10-8mol·L-1,此时pH=6;若上述过程不加H2O2后果是:Zn(OH)2和 Fe(OH)2的Ksp相近,同时沉淀,Zn2+和Fe2+分离不开。
mol·L-1=10-8mol·L-1,此时pH=6;若上述过程不加H2O2后果是:Zn(OH)2和 Fe(OH)2的Ksp相近,同时沉淀,Zn2+和Fe2+分离不开。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.价电子排布为ns1的元素,不一定是s区元素
B.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
C.光卤气(COCl2)、甲醛分子的立体构型和键角均相同
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/LH2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
①H2SO4溶液中的HSO | ②NaHSO4溶液中的HSO | ③CH3COOH | ④HCl溶液 |
10% | 29% | 1.33% | 100% |
(1)写出H2SO4在水中的电离方程式___。
(2)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为___。
(3)根据题设条件计算CH3COOH的电离常数Ka=___。若常温下,将bmol·L–1的CH3COONa液与0.01mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
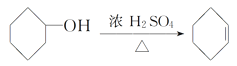 +H2O
+H2O

可能用到的有关数据如下:
相对分子质量 | 密度/ g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是______。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________。
(4)分液漏斗在使用前须清洗干净并______;在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转。

请回答下列问题:
(1)通入 CH3OH 电极的电极反应:___________________。
(2)乙池中 A(石墨)电极的名称为_________________(填“正极”、“负极”或“阴极”、“阳极”),总化学反应式为___________________。
(3)当乙池中 B 极质量增加 5.40g 时,甲池中理论上消耗 O2 的体积为_______mL(标准状况)。若丙池中KCl溶液的体积是500mL,电解后,溶液的pH为_________(设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X的一种氢化物与其最高价氧化物对应水化物反应生成盐。下列说法正确的是
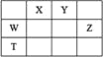
A. X的氢化物的沸点一定低于同主族元素形成的其他氢化物
B. 由Y、Z和氢三种元素形成的化合物中,Z的化合价越高氧化性越强
C. W的氧化物是酸性氧化物,能与碱、水反应,不能与酸反应
D. T元素单质具有半导体的特性,T与Y元素可形成两种化合物TY和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶休,结构如图所示,有关说法不正确的是
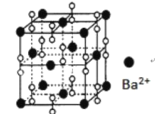
A.该晶体属于离子晶体
B.该晶体晶胞结构与NaCl相似
C.晶体的化学式为Ba2O2
D.与每个Ba2+距离相等且最近的 Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法在化学的发展中起到非常重要的作用,下列分类标准合理的是( )
![]() 根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物和两性氧化物
根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物和两性氧化物
![]() 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
![]() 根据分散系是否有丁达尔效应将分散系分为溶液、浊液和胶体
根据分散系是否有丁达尔效应将分散系分为溶液、浊液和胶体
![]() 根据酸分子中含有氢原子的数目可把酸分为一元酸、二元酸、三元酸等
根据酸分子中含有氢原子的数目可把酸分为一元酸、二元酸、三元酸等
![]() 根据水溶液能否导电将化合物分为电解质和非电解质
根据水溶液能否导电将化合物分为电解质和非电解质
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() ,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min | 2 | 4.5 | 5 | 6 |
X的转化率 | 30% | 40% | 70% | 70% |
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5min时,![]()
C.6min时,容器中剩余1.4molY
D.其他条件不变,将X的物质的量改为10mol,则可得到4molZ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com