
| 序号 | x(O2) | 与O2反应的 (Q1/kJ) | 与H2O反应的 (Q2/kJ) | 总反应的 (Q3/kJ) |
| I | 0.2 | -18 | ||
| Ⅱ | -36 | +72 |
分析 (1)反应是吸热反应,反应物能量低于生成物能量;
(2)依据热化学方程式的定量关系计算分析,氧气和水蒸气的混合气体中氧气的物质的量分数为x,反应焓变分正负,注意总焓的计算.
解答 解:(1)②反应为吸热反应,则反应物能量小于生成物能量,所以参加反应的CH4(g)与H2O(g)的总能量小于生成的CO(g)与H2(g)的总能量,
故答案为:小于;
(2)Ⅰ、反应①反应热-18,则参加反应的O2为0.25mol,氧气的物质的量分数0.2,则水蒸气物质的量为1mol,反应②反应热+216,总反应反应热+198;
Ⅱ、反应①反应热-36,则参加反应的O2为0.5mol,总反应反应热+72,反应②反应热+108,参加反应的水蒸气为0.5mol,氧气的物质的量分数0.5.
故答案为:
| 序号 | x(O2) | 与O2反应的 (Q1/kJ) | 与H2O反应的 (Q2/kJ) | 总反应的 (Q3/kJ) |
| I | 0.2 | -18 | +216 | +198 |
| Ⅱ | 0.5 | -36 | +108 | +72 |
点评 本题考查了化学反应的反应热的计算分析,主要是热化学方程式的计算应用,掌握基础是关键,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| D. | 0.5mol雄黄(As4S4,结构如图),含有NA个As-S键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g NH3 | B. | 0.1mol NH4NO3 | C. | 6g NH4NO3 | D. | 13.2g (NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S属于非电解质 | B. | NO和CO都属于酸性氧化物 | ||
| C. | H2S只有还原性没有氧化性 | D. | H2S、NO和CO都能与臭氧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
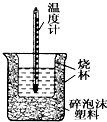 50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com