
| A. | 对硝基甲苯的结构简式: | B. | S2-离子的结构示意图: | ||
| C. | CO2的分子比例模型: | D. | 次氯酸的电子式: |
分析 A.对硝基甲苯中苯环连接氮原子;
B.硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构;
C.二氧化碳为直线型结构,碳原子的原子半径大于氢原子;
D.次氯酸的中心原子为氧原子,分子中不存在H-Cl键.
解答 解:A.对硝基苯酚的结构简式中,硝基表示错误,正确的结构简式为: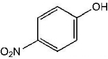 ,故A错误;
,故A错误;
B.硫离子的核电荷数为16,最外层满足8电子稳定结构,S2-离子的结构示意图为: ,故B正确;
,故B正确;
C.二氧化碳的分子式为CO2,由模型可知小球为碳原子,2个大球为氧原子,氧原子半径大,实际碳原子半径大于氧原子半径,其正确的比例模型为: ,故C错误;
,故C错误;
D.次氯酸为共价化合物,H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,则其电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、结构简式、比例模型、离子结构示意图等知识,明确常见化学用语的概念及书写原则为解答关键,试题有利于培养学生的分析能力及规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 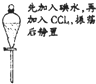 实验:液体分层,上层呈紫红色 | |
| B. | 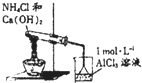 实验:烧杯中先出现白色沉淀,后溶解 | |
| C. | 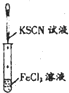 实验:试管中溶液颜色变为血红色 | |
| D. | 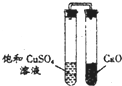 实验:放置一段时间后,饱和CuSO4溶液中出现白色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
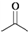 ,则
,则 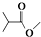 分子式:C5H8O2.
分子式:C5H8O2. .
. .
.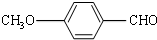 有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是:
有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是: 、
、 ;
; ,
, (任意两种)(任写其中二种).
(任意两种)(任写其中二种). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
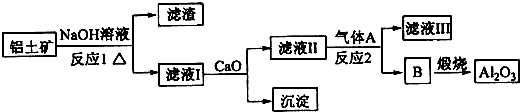
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②⑤ | C. | ②⑤⑥ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,4.48 L N2和O2的混合气体中所含原子数为0.4NA | |
| B. | 常温下,1.0 L 1.0 mol•L-1NaAlO2溶液中含有的氧原子数为2NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| D. | 0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
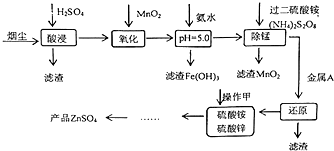 高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com