
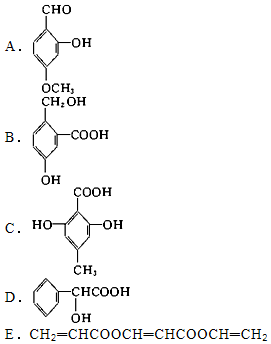
分析 (1)含-OH,且与脂肪烃基相连的为醇;
(2)含-OH,且与苯环直接相连的为酚;
(3)含-COOH的有机物为羧酸;
(4)含-COOC-的有机物属于酯类;
(5)含-CHO的属于醛类,以此来解答.
解答 解:(1)含-OH,且与脂肪烃基相连的为醇,只有BD符合,故答案为:BD;
(2)含-OH,且与苯环直接相连的为酚,只有ABC符合,故答案为:ABC;
(3)含-COOH的有机物为羧酸,只有BCD符合,故答案为:BCD;
(4)含-COOC-的有机物属于酯类,只有E符合,故答案为:E;
(5)含-CHO的属于醛类,只有A符合,故答案为:A.
点评 本题考查有机物的官能团及分类,为高频考点,把握官能团与物质分类的关系为解答的关键,侧重分析与应用能力的考查,注意有机物的分类,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加 | |
| B. | 对于有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 改变条件能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的有效碰撞几率 | |
| D. | 对于本来不能发生的化学反应,改变条件可以使反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 混合物成分 | 除杂试剂 | 化学方程式 |
| (1)铜粉中混有铁粉 | ||
| (2)铁粉中混有铝粉 | ||
| (3)Al2O3中混有Al(OH)3 | ||
| (4)FeCl3溶液中混有FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.12g | B. | 4.18g | C. | 4.68g | D. | 5.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2O2和H2O 反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 用氢氧化钠溶液除去金属铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 用食醋除去水瓶中的水垢:2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O | |
| D. | 等体积、等浓度的Ba(OH)2浓溶液和NH4HCO3 浓溶液混合后并加热Ba2++OH-+HCO3-═BaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com