
【题目】实验室可通过反应;3Cl2+6KOH![]() 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
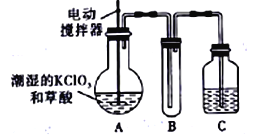
请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:_______________________________。
(2)请分析装置图,进行补充和完善。A部分缺___________装置,B部分还应补充____________装置,还有一处设计明显不合理的是___________(填“A”“B”或“C”)
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离于方程式:______________________________________。
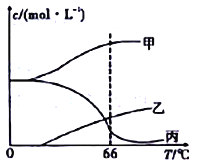
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是______________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是____________________(不考虑Cl2的挥发)
(5)测定KClO3样品中C1O3-的含量,称取样品ag,准确配制成1000mL溶液,从上述溶液中取出10.00mL 于锥形瓶中,准确加入30.00mL 1.00 molL-1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100mL 蒸馏水及某种指示剂,用0.200 molL-1K2Cr2O7标准溶液滴定至终点,消耗5.00mL。样品中C1O3-的质量分数为_________。(已知Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O,C1O3-可被Fe2+还原为Cl-)
【答案】 2KClO3+H2C2O4 ![]() K2CO3+CO2↑ +2C1O2↑+H2O 水浴加热 盛有冰水混合物的水槽(或冰水浴) C 2ClO2+2OH- = C1O2- +ClO3- +H2O KClO Cl-、ClO3-、ClO-
K2CO3+CO2↑ +2C1O2↑+H2O 水浴加热 盛有冰水混合物的水槽(或冰水浴) C 2ClO2+2OH- = C1O2- +ClO3- +H2O KClO Cl-、ClO3-、ClO- ![]() %
%
【解析】本题主要考查有关氧化还原反应的方程式的书写和计算。
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,该正盐是碳酸钾,该反应的化学方程式:2KClO3+H2C2O4 ![]() K2CO3+CO2↑ +2C1O2↑+H2O。
K2CO3+CO2↑ +2C1O2↑+H2O。
(2)A部分缺加热装置,由于加热温度低于100℃,所以应用水浴加热,B部分还应补充冷凝装置,可用冰水浴,还有一处设计明显不合理的是C,因为气体实验装置使用封闭装置有危险。
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,该反应的离于方程式:2ClO2+2OH- = C1O2- +ClO3- +H2O。
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是KClO;图中甲、乙、丙依次表示的离子是Cl-、ClO3-、ClO-。
(5)反应Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O消耗(NH4)2Fe(SO4)26×0.200molL-1×5.00mL=6mmol,KClO3样品中C1O3-消耗(NH4)2Fe(SO4)2(1.00molL-1×30.00mL-6mmol)=24mmol,agKClO3样品中C1O3-的物质的量为10×24mmol/6=40mmol,样品中C1O3-的质量分数为40mmol×83.5g/mol/ag= ![]() %。
%。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】聚乙烯![]() 可用于制作食品包装袋,在一定条件下可通过乙烯生成聚乙烯,下列说法中正确的是( )
可用于制作食品包装袋,在一定条件下可通过乙烯生成聚乙烯,下列说法中正确的是( )
A. 燃烧等质量的乙烯和聚乙烯时,聚乙烯消耗的氧气多
B. 乙烯比乙烷的含碳量高,燃烧时容易产生浓烟
C. 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
D. 乙烯和聚乙烯都能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产、材料和环境关系非常密切,下列说法不正确的是
A. 将草木灰与NH4H2PO4混合施用可更好地为植物全面提供N、P、K 三种营养元素
B. 酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关
C. 金刚砂和氧化铝透明陶瓷都属于无机非金属材料
D. 用K2FeO4代替Cl2处理饮用水,既能杀菌又能净水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1;
③4Li(s)+O2(g)===2Li2O(s) ΔH=-1196 kJ·mol-1。
试写出LiH在O2中燃烧的热化学方程式:__________________________________________。
(II)利用H2和CO2生产甲醇。某温度下,在容积为2L的密闭容器中充入1molCO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
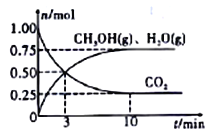
(1)从反应开始到3min时,氢气的平均反应速率v(H2)=____________。
(2)下列措施中一定能使CO2的转化率增大的是_______________(填序号)。
A.在原容器中再充入1mol CO2 B.在原容器中再充入1mol H2
C.在原容器中再充入1mol He D.使用更有效的催化剂
E. 缩小容器的容积 F. 将水蒸气从体系中分离出
(III)图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
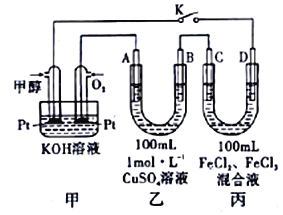
(1)甲中负极的电极反应式为_______________________________。
(2)乙中A极析出的气体在标准状况下的体积为_______________________。
(IV)已知常温下CN-的水解常数Kb=1.61×10-5。
(1)常温下,含等物质的量浓度的HCN与NaCN的混合溶液显_________(填“酸”“碱”或“中”)性,c(CN-)_______(填“>”“<”或“=”)c(HCN)。
(2)常温下,若将c molL-1盐酸与0.61 molL-1KCN溶液等体积混合后恰好得到中性溶液,则c=________(小数点后保留4位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是
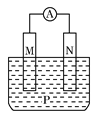
M | N | P | |
A | Zn | Cu | 稀H2SO4溶液 |
B | Cu | Fe | 稀HCl溶液 |
C | Ag | Zn | AgNO3溶液 |
D | Zn | Fe | Fe(NO3)3溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。化学原理:CH2=CH2(g)+H2O(g)→CH3CH2OH(g)△H。已知几种共价键的键能如下表所示:
化学健 | C-H | C=C | H-O | C-C | C-O |
健能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是( )
A. 上述合成乙醇的反应是加成反应
B. 相同时间段内,反应中用三种物质表示的反应速率相等
C. 碳碳双键的键能小于碳碳单键键能的2倍
D. 上述反应式中,△H=-96kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.根据一次能源和二次能源的划分,氢气为二次能源
B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源
C.火电是将燃料中的化学能直接转化为电能的过程
D.在火力发电时,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明可逆反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是( )
2NH3(g)已达到平衡状态的是( )
①6个N—H键形成的同时,有3个H—H键断裂;②3个H—H键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3、N2、H2的体积分数都不再改变;⑥恒温恒容时,密度保持不变;⑦3v(N2)正 =v(H2)逆;⑧容器内A、B、C、D四者共存 ⑨NH3的生成速率与分解速率相等; ⑩A 、B、C的分子数目比为1:3:2。
A. 全部 B. ①③④⑤⑧ C. ②③④⑤⑦⑨ D. ①③⑤⑥⑦⑩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com