
| A. | Cl2 | B. | BaSO4 | C. | SO2 | D. | CH3COOH |
分析 电解质是指:在水溶液中或熔融状态下能够导电的化合物;电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
非电解质是指:在熔融状态和水溶液中都不能导电的化合物;也就是说,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子;
单质、混合物,既不是电解质也不是非电解质,溶液能导电说明含有自由移动的离子,据此分析即可解答.
解答 解:A.Cl2是单质,既不是电解质也不是非电解质,故A错误;
B.BaSO4在熔融状态下能完全电离出自由移动的阴阳离子而导电,是电解质,但BaSO4不溶于水,因此水溶液不导电,故B错误;
C.二氧化硫为化合物,其水溶液是亚硫酸溶液,能导电,但其本身不发生电离,属于非电解质,故C正确;
D.CH3COOH在水溶液中电离方程式为:CH3COOH?CH3COO-+H+有自由移动的乙酸根离子和氢离子能导电,是化合物,所以是电解质,故D错误;
故选C.
点评 本题主要考查了非电解质概念的辨析,关键注意非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子,题目难度不大.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 氢氧化铝、碳酸氢钠都可用于治疗胃酸过多 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入适量食品添加剂 | |
| D. | 用化纤面料替代棉质面料,以减少二氧化碳的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青砖(含Fe3O4)中的Fe2+可用浓盐酸溶解后,再加入适量高锰酸钾溶液进行检验 | |
| B. | 用0.1000 mol•L-1 NaOH溶液滴定20.00 mL未知浓度盐酸,接近终点时因滴速太快造成NaOH少许过量;此时若加入一定体积该盐酸后,继续用该NaOH溶液恰好滴定至终点,则测得的盐酸浓度将偏大 | |
| C. | 为了使实验现象明显,在做吸氧腐蚀实验时,不能用没有处理过的镀锌铁皮代替生铁 | |
| D. | 检查容量瓶瓶口是否漏水的方法是:往瓶内加入一定量水,塞好瓶塞.用食指摁住瓶塞,另一只手托住瓶底,把瓶倒转过来,观察瓶塞周围是否有水漏出即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- | |
| B. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| D. | 金属铝溶于盐酸中:Al+2H+═Al3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
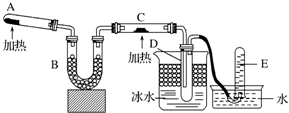
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,促进CO32-水解,pH减小 | |
| B. | 离子浓度:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| C. | 离子浓度:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(H+)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、MnO4-、SO42- | B. | OH-、K+、HCO3-、SO32- | ||
| C. | H+、Mg2+、Cl-、Br- | D. | Al3+、NH4+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
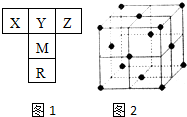 如图1是元素周期表的一部分.已知R的核电荷数小于36,气态氢化物沸点:MHn>YHn.
如图1是元素周期表的一部分.已知R的核电荷数小于36,气态氢化物沸点:MHn>YHn.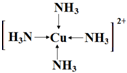
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
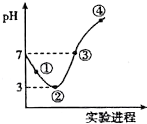 常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 用pH试纸测①处c(H+)约为②处c (H+)的两倍 | |
| B. | 可依据②处数据计算所溶解的n(Cl2) | |
| C. | ③处表示溶液中,c(Na+)=c(ClO-)+c(Cl-) | |
| D. | 曲线③④段有离子反应:HClO+OH-→ClO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com