
【题目】下面所示是实验室制取SO2,并验证SO2的某些性质的装置图。试回答:

(1)②可证明SO2有___性;③可证明SO2有___性。
(2)④中的实验现象是__,证明SO2有___性。
(3)⑤的作用是___。
【答案】漂白 氧化 高锰酸钾溶液的紫色褪去 还原 吸收尾气中的SO2
【解析】
(1)二氧化硫具有漂白性,能与品红溶液中的有色物质结合生成不稳定的无色物质,使品红溶液褪色,SO2与H2S溶液反应的化学方程式为SO2+2H2S=3S↓+2H2O,有淡黄色沉淀生成,SO2中硫元素化合价降低,做氧化剂,具有氧化性,故答案为:漂白;氧化;
(2)二氧化硫有还原性,能和酸性KMnO4溶液发生氧化还原反应,使KMnO4溶液褪色,故答案为:高锰酸钾溶液的紫色褪去;还原;
(3)二氧化硫有毒且是空气污染物,氢氧化钠能够吸收二氧化硫,⑤装置中盛装NaOH溶液的作用是吸收SO2,防止污染空气,故答案为:吸收尾气中的SO2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是( )
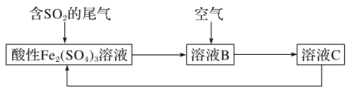
A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:O2>SO42-
D.检验溶液B中是否含Fe2+的方法:向溶液B中加入硫氰化钾溶液,无现象,然后加入双氧水溶液,观察是否变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工程师为了从使用过的腐蚀废液中回收铜,并重新获得![]() 溶液,准备采用如图步骤:
溶液,准备采用如图步骤:

(1)请写出上述实验中加入或生成的有关物质的化学式:①______________,②______________
(2)滤渣加过量④的化学方程式______________
(3)含有②的滤液与⑤反应的化学方程式为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿石含碳酸镁和石英,制备高纯硅和硅胶的工艺流程如下:

(1)“硅胶”冶常用作_______________ ,也可以用作__________的载体。 A 的结构式为________。
(2)制备粗硅的方程式为_______。
(3)操作I为_____________,操作Ⅱ为_______________,操作Ⅲ所用仪器有铁架台(带铁圈)、酒精灯、_______________等。
(4)操作Ⅲ,需要在氯化氢气流中加热脱水的原因是_______________。
(5)溶液G用E酸化的方程式为_______________。
(6)电解饱和的K溶液的离子方程式为____________,阳极电极方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+=4Fe3++2H2O,则另一反应的离子方程式为__________;
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:

①操作Ⅰ的名称是__________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________;
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式: __________;
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.01000 mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00 mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是__________(填字母序号)。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案进行实验探究:
方案一:

(1)根据方案一装置回答以下问题:
写出装置①发生的化学反应方程式:___。若将反应后②中的溶液倒入苯中,振荡静置后,出现的现象与如图吻合的是___。(填代号)装置③中的现象是___。

(2)根据方案二装置回答以下问题:
方案二:

方案二验证元素非金属性递变的理论依据是:___。B装置的作用是___,X试剂是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA (气) ![]() bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质A的质量分数增加了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.1 molMnO2粉末加入50 mL过氧化氢的溶液里(密度为1.1 g·mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示。
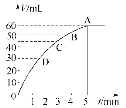
(1)实验时放出气体的体积为__________。
(2)放出一半气体所需的时间约为____________。
(3)根据曲线形状解释反应速率变化的原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为单质,C为化合物,能实现上述转化关系的是( )
![]()
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com