
 (1)利用反应6NO2+8NH3
(1)利用反应6NO2+8NH3| 催化剂 |
| △ |
| 催化剂 |
| 加热 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
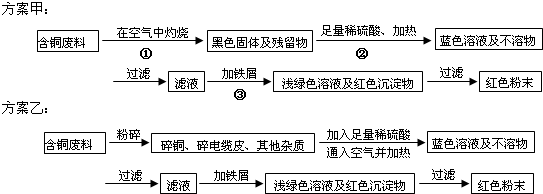
查看答案和解析>>
科目:高中化学 来源: 题型:
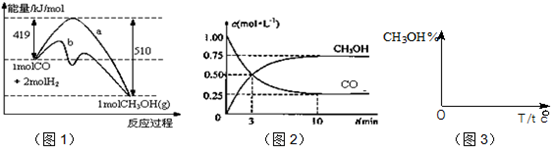
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5值越大,形成雾霾天气的可能性越大 |
| B、PM2.5容易附着有毒有害物质,尤其是重金属,对人体造成危害 |
| C、城市由于汽车尾气的大量排放,比农村形成雾霾天气的可能性更大 |
| D、氟利昂作制冷剂会加剧雾霾天气的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一部分为Al(OH)3,一部分为Al3+ |
| B、全部为Al(OH)3 |
| C、一部分为Al(OH)3,一部分为AlO2- |
| D、全部为AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成的Al(OH)3的质量相等 |
| B、含a mol Na2CO3的溶液和含1.5a mol HCl的稀盐酸,无论正滴和反滴,生成的CO2相等 |
| C、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
| D、二份质量相等组成不同的铝钠合金分别投入到足量盐酸中,若放出的H2越多,则铝的质量分数越小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com