
【题目】(1)下列原子或离子的电子排布的表示方法中,正确的是___,违反了能量最低原理的是___,违反洪特规则的是__。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P:![]()
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
⑦C:![]()
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(2)基态Al原子中,电子填充的最高能级是___,基态Cr原子的价电子排布式是___。
(3)用“>”或“<”填空:
第一电离能 | 沸点 | 离子半径 |
Be___B | H2S___H2O | Al3+___O2- |
(4)卟啉与Fe2+合即可形成血红素,Fe2+的电子排布式为___,铁在周期表中的位置为__。
【答案】①⑤⑥ ② ③④⑦ 3p 3d54s1 > < < 1s22s22p63s23p63d6 第四周期第Ⅷ族
【解析】
(1)根据构造原理确定核外电子排布式是否正确,能量最低原理:原子核外电子先占有能量较低的轨道.然后依次进入能量较高的轨道;泡利不相容原理:每个原子轨道上最多只能容纳 2个自旋状态 相反的电子;洪特规则:在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同。
(2)根据核外电子排布规律可以写出价电子排布式,根据充满和半充满状态能量最低也是最稳定的状态进行分析;
(3)Be、B同周期自左而右元素的第一电离能呈增大趋势,ⅡA族反常;水分子间含有氢键;核外电子数相同的,原子序数越大,半径越小;
(4)Fe是26号元素,其原子核外有26个电子,失去两个最外层电子生成亚铁离子,根据构造原理书写其核外电子排布式;
(1)①正确;②违反了能力最低原子;③违反了洪特规则;④违反了洪特原则;⑤正确;⑥正确;⑦违反了洪特规则;故答案为:①⑤⑥;②;③④⑦;
(2)Al为13号元素,其电子排布式为1s22s22p63s23p1,最高能级为3p,根据核外电子排布规律可以写出基态铬价电子排布式为1s22s22p63s23p63s23p63d54s1,所以基态铬(Cr)原子的价电子排布式是3d54s1,故答案为:3p;3d54s1;
(3)同周期自左而右元素的第一电离能呈增大趋势,但ⅡA族最外层为ns能级容纳2个电子,为全满确定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能B<Be;水分子间含有氢键,使得水的分子间作用力大于硫化氢分子的,故水的沸点大;电子层数越多半径越大,核外电子数相同的,原子序数越大,半径越小,O2-、Al3+有2个电子层,O的原子序数小所以O2-半径比Al3+大,所以离子半径O2->Al3+,故答案为:>;<;<;
(4)Fe是26号元素,其原子核外有26个电子,失去两个最外层电子生成亚铁离子,根据构造原理书写其核外电子排布式为1s22s22p63s23p63d6,铁元素在元素周期表的位置为第四周期第Ⅷ族,故答案为:1s22s22p63s23p63d6;第四周期第Ⅷ族。


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】在![]() 时,在浓度为
时,在浓度为![]() 的
的![]() 、
、![]() 、
、![]() 的溶液中,已知醋酸的电离常数约等于一水合氨的电离常数,下列判断正确的是
的溶液中,已知醋酸的电离常数约等于一水合氨的电离常数,下列判断正确的是![]()
A.由水电离出的![]() 最大的是
最大的是![]()
B.三种溶液的pH值最小的![]()
C.三种溶液中![]() 最大的是
最大的是![]()
D.三种溶液中只有![]() 显碱性
显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 检验蔗糖水解生成葡萄糖 | 取适量蔗糖溶于盛有蒸馏水的试管中,滴入稀硫酸加热一段时间,冷却,滴入新制氢氧化铜悬浊液,加热至沸腾,观察有无砖红色沉淀 |
B | 实验室制备氢氧化铁胶体 | 向盛有25mL蒸馏水的烧杯中滴入5-6滴氯化铁饱和溶液,加热煮沸至溶液呈红褐色,停止加热 |
C | 比较AgCl、AgI的Ksp大小 | 向盛有10滴0.1mol/LAgNO3 溶液的试管中滴加0.1mol/LNaCl溶液至不再有沉淀生成,再滴加0.1mol/lKI溶液 |
D | 比较Mg、Al的金属性强弱 | 用导线连接镁和铝片,插入盛有氢氧化钠溶液的烧杯中,观察气泡 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】融雪剂通过降低冰雪融化温度的原理融化道路上的积雪。研究发现,一般融雪剂残留物可腐蚀路面和汽车轮胎等。目前我国北方在冬季仍采用沙土和铲雪车为主,融雪剂为辅的方式清除路面冰雪,保证道路通畅。
请回答下列问题:
(1)氯化钙是常用融雪剂的主要成分之一,以工业碳酸钙(含有少量Na+、Mg2+、Fe3+等杂质)生产氯化钙的主要流程如下:

①流程中试剂W的名称是 ________________。
②流程中滤渣的主要成分是________________(填化学式)。
③流程中操作Y的目的是_______________。
④如果用惰性电极电解用试剂W溶解后的溶液,则电解开始时阴极发生的电极反应式为_________。
(2)下列就融雪剂使用的有关原理的解释正确的是_________________。
A.“会加快冰雪的融化”是因为提高了冰点
B.“会造成绿化植物死亡”是与盐析有关
C.“会造成土壤板结贫瘠”是与物质的分解吸热有关
D.“会加快路基上铁的腐蚀”是与形成原电池有关
(3)某公司生产的融雪剂由NaCl、NaNO3、AlCl3、CuSO4、K2CO3中的几种物质组成。某同学设计下列过程探究其组成:
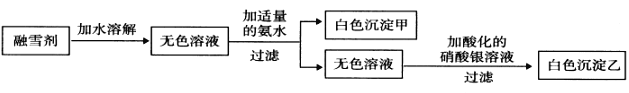
请回答下列问题:
①该融雪剂中一定不含的物质是_________________(填名称)。
②若取融雪剂样品a g,通过上述探究途径得白色沉淀乙bmol,则该融雪剂中含氯元素的质量分数为 ____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)用___式滴定管盛装cmol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是___。如图表示某次滴定时50mL滴定管中前后液面的位置。滴定管读数时应注意___。用去的标准盐酸的体积是___mL。
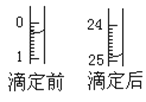
(2)该实验应选用__(填“酚酞”或者“石蕊”)作指示剂;操作中如何确定终点?__。
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果___;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果___;
C,读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A. 当混合气体的平均相对分子质量保持不变时,反应达平衡
B. 增大压强,各物质的浓度不变
C. 升高温度,平衡常数K增大
D. 增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx会造成大气污染,在工业上采用多种方法进行处理。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,CaSO4的沉淀溶解平衡常数数值为9.1×10-6,CaSO3的沉淀溶解平衡常数数值为3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
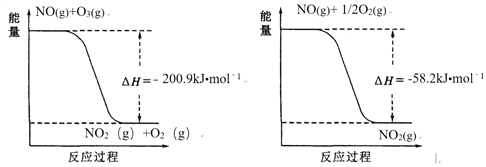
NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 ________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为________。
(3)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为________。
(4)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:________。
II. 选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用NH3做还原剂与 NOx 进行选择性反应:4NH3 + 4NO + O2 ![]() 3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
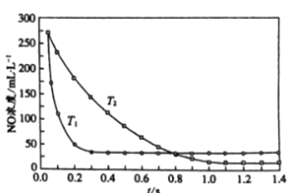
(5)判断该反应为________(填“吸热”或“放热”)反应,说明理由:________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是![]()
选项 | 实验操作 | 实验目的或结论 |
A | 向含有少量 | 除去 |
B | 向某溶液中加入 | 证明溶液中含 |
C | 向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水,石灰水变浑浊 | 证明该溶液中存在 |
D | 向 | 证明 |
A.AB.BC.CD.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。

请回答下列问题。
(1)该电池属于_________电池(填“一次”或“二次”)。
(2)负极是_________,电极反应式是__________________________。
(3)使用时,正极区的pH_________(填“增大”、“减小”或“不变”)。
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____。(填字母)
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2CO(g)+O2(g)=2CO2(1) △H<0
(5)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com