
科目:高中化学 来源: 题型:选择题
| A. | 4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$Fe+4CO2 | B. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,S2和S8的固体混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 将1molFeCl3滴入足量沸水中,所分散系中粒子数目小于NA | |
| C. | 6.4g铜与硫反应时,铜失去的电子数为0.2NA | |
| D. | 标准状况下,44.8L NO与22.4L O2混合后气体中分子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L乙醇中分子数为NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为22.4L | |
| C. | 1.8g的NH4+中含有的电子数为1.1NA | |
| D. | 在1 L 2 mol/L的盐酸中,存在2NA个氯化氢分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
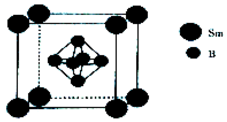 硼及其化合物在工农业生产中应用广泛.
硼及其化合物在工农业生产中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用ClO2处理后的自来水中,ClO2的浓度应在0.10~0.80mg/L之间.用碘量法检测水中C1O2浓度的实验步骤如下:
用ClO2处理后的自来水中,ClO2的浓度应在0.10~0.80mg/L之间.用碘量法检测水中C1O2浓度的实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com