
| A、0.1mol/L的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
| B、体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等量的镁粉,前者用时少 |
| C、将n mol H2(g)、n mol I2(g)和2n mol H2(g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D、室温下,某溶液中由水电离出的c(H+)=10-a mol/L,a<7时,溶液的pH一定为14-a |


科目:高中化学 来源: 题型:
| A、4 | B、4.5 | C、5 | D、5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑥ | B、①③⑤ |
| C、②③⑥ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铜溶液 |
| B、硝酸钠溶液 |
| C、醋酸钠溶液 |
| D、氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
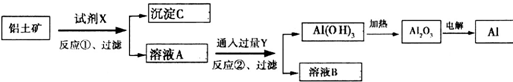
| A、反应①中试剂X是氢氧化钠溶液 |
| B、试剂Y是HCl,它与[Al(OH)4]-反应生成氢氧化铝 |
| C、图中所示转化反应中包含2个氧化还原反应 |
| D、将X与Y试剂进行对换,最终可以达到相同结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaOH溶液中慢慢滴加FeCl3饱和溶液,可制得Fe(OH)3胶体 |
| B、胶体与其他分散系的本质区别是胶体能发生丁达尔效应 |
| C、Fe(OH)3胶体中的分散质为氢氧化铁分子 |
| D、向沸水中滴加FeCl3饱和溶液,加热至溶液变为红褐色,停止加热,制得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沸点:NH3>PH3>AsH3 |
| B、熔点:Si3N4>NaCl>SiI4 |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙醇与浓氢溴酸反应CH3CH2OH+HBr
| |||
B、溴乙烷与氢氧化钠溶液共热CH3CH2Br+NaOH
| |||
C、苯酚钠中通入二氧化碳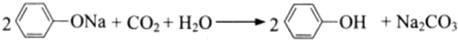 | |||
D、蔗糖在稀硫酸作用下水解C12H22011(蔗糖)+H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com