

 .
.
分析 根据元素在周期表中的位置知,a-g分别是N、F、Al、S、Cl、Co、Cu元素,
(1)a是N元素,a的氢化物是氨气,氨气分子中N原子价层电子对个数是3且含有一个孤电子对,根据价层电子对互斥理论判断N原子杂化方式、氨气分子空间构型;
d是S元素,S元素的最高价氧化物是三氧化硫,三氧化硫分子中价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断三氧化硫分子空间构型及原子杂化方式,正负电荷重心重合的分子为非极性分子,不重合的分子为极性分子;
(2)F、S、Cl三种元素的氢化物中,含有氢键的氢化物沸点最高;
(3)将Cu的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,铜离子含有空轨道、水分子中O原子含有孤电子对,二者形成配位键,配位键由含有孤电子对的原子指向含有空轨道的原子;
(4)Co(NH3)5BrSO4可形成两种配合物,已知Co3+的配位数是6,为确定Co的配合物的结构,配合物外界能电离出自由移动的离子,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,说明外界中含有硫酸根离子,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,说明外界中不含硫酸根离子,因为配合物的配位数是6,所以第二种配合物的配体是氨气、硫酸根离子,外界是溴离子;
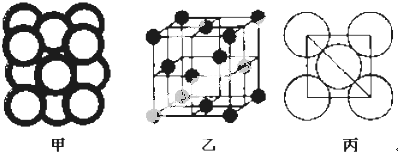
(5)Al单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示,Al原子配位数=3×8×$\frac{1}{2}$;Al原子的半径为r,晶胞棱长=2$\sqrt{2}$r,体积=(2$\sqrt{2}$r)3,该晶胞中Al原子个数=$8×\frac{1}{8}+6×\frac{1}{2}$=4,密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:根据元素在周期表中的位置知,a-g分别是N、F、Al、S、Cl、Co、Cu元素,
(1)a是N元素,a的氢化物是氨气,氨气分子中N原子价层电子对个数是3且含有一个孤电子对,根据价层电子对互斥理论知N原子杂化方式为sp3、氨气分子空间构型为三角锥形;
d是S元素,S元素的最高价氧化物是三氧化硫,三氧化硫分子中价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知三氧化硫分子空间构型为平面正三角形,S原子杂化方式sp2,该分子正负电荷重心重合,所以为非极性分子,
故答案为:三角锥形;sp3;平面正三角形;sp2;非极性分子;
(2)F、S、Cl三种元素的氢化物中,含有氢键的氢化物沸点最高,只有HF中含有氢键,所以熔沸点最高的是HF,故答案为:HF;只有HF中含有氢键;
(3)将Cu的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,铜离子含有空轨道、水分子中O原子含有孤电子对,二者形成配位键,配位键由含有孤电子对的原子指向含有空轨道的原子,则该配离子为 ,故答案为:
,故答案为: ;
;
(4)Co(NH3)5BrSO4可形成两种配合物,已知Co3+的配位数是6,为确定Co的配合物的结构,配合物外界能电离出自由移动的离子,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,说明外界中含有硫酸根离子,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,说明外界中不含硫酸根离子,因为配合物的配位数是6,所以第二种配合物的配体是氨气、硫酸根离子,外界是溴离子,其化学式为[Co(NH3)5SO4]Br,
故答案为:[Co(NH3)5SO4]Br;NH3;SO42-;
(5)Al单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示,Al原子配位数=3×8×$\frac{1}{2}$=12;
Al原子的半径为r,晶胞棱长=2$\sqrt{2}$r,体积=(2$\sqrt{2}$r)3,该晶胞中Al原子个数=$8×\frac{1}{8}+6×\frac{1}{2}$=4,密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{M}{4\sqrt{2}{r}^{3}{N}_{A}}$,
故答案为:12;$\frac{M}{4\sqrt{2}{r}^{3}{N}_{A}}$.
点评 本题考查位置结构性质相互关系及应用,涉及晶胞计算、原子杂化方式判断、配位键、氢键等知识点,这些都是高频考点,难点是晶胞计算,注意外界和內界区别及配位键表示方法,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 升高温度 | B. | 增大压强 | C. | 增大NH3的浓度 | D. | 使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 与HCN反应引入:
与HCN反应引入: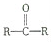 $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$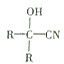
 $→_{一定条件①}^{HCN}$ A $→_{②}^{H_{2}O,H+}$ B$→_{③}^{浓H_{2}SO_{4},△}$ C $→_{催化剂④}^{聚合}$ D
$→_{一定条件①}^{HCN}$ A $→_{②}^{H_{2}O,H+}$ B$→_{③}^{浓H_{2}SO_{4},△}$ C $→_{催化剂④}^{聚合}$ D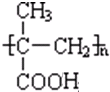 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是制造太阳能电池的常用材料 | |
| B. | 二氧化硅是制造光导纤维的材料 | |
| C. | 氢氟酸可用刻蚀玻璃 | |
| D. | 硅是制取水泥的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体中阴、阳离子 | B. | NH3分子中的质子和电子 | ||
| C. | Na2O2固体中阴、阳离子 | D. | ${\;}_{1}^{2}$H原子中的质子和中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-戊烯的同分异构体数目为五种 | |
| B. | 丙烯与HCl加成产物是1-氯丙烷 | |
| C. | 组成为CnH2n的烃,当n=4时,才具有同分异构体 | |
| D. | 能使溴水或酸性KMnO4溶液褪色的C4H8的物质可能有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅在O2中 | B. | 仅在NO2中 | C. | 仅在O2和NO2中 | D. | 平衡体系中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com