
| A、加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 |
| B、钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,进行灼烧,直接观察火焰颜色 |
| C、加入NaOH溶液,加热,放出能使湿润的红色石蕊试纸变蓝的气体,证明一定含有NH4+ |
| D、加入AgNO3溶液,有白色沉淀生成,证明含有Cl- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、10g质量分数为46%的乙醇的水溶液中,氢原子的总数为0.6NA |
| B、5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA |
| C、50 mL 12 mol?L-1 浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D、常温常压下,46g NO2与N2O4的混合气体中含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
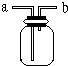 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.查看答案和解析>>
科目:高中化学 来源: 题型:
| K+ | Na+ | NH4+ | SO42- | NO3- | Cl- | |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 50 |
| 1 |
| 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.
某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.查看答案和解析>>
科目:高中化学 来源: 题型:
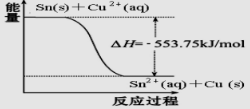
查看答案和解析>>
科目:高中化学 来源: 题型:
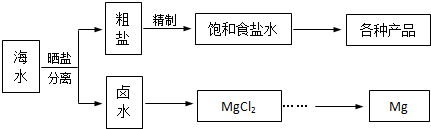
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 8.3 | 9.6 |
| 沉淀完成 | 3.7 | 9.6 | 9.5 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 |
| B、乙烯的化学性质比聚乙烯活泼 |
| C、取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
| D、取等物质的量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的物质的量分别相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com