
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$结合分子的构成计算.
解答 解:(1)由n=$\frac{V}{{V}_{m}}$可知,等物质的量的CO和CO2,二者体积比为1:1,
根据N=nNA可知,分子数之比等于物质的量之比,
而1个CO分子中含有1个C原子,1个O原子,1个CO2分子中含有1个C原子,2个O原子,
所以:等物质的量的CO和CO2中所含原子个数之比2:3,
m=nM,二者的质量之比为:m(CO):m(CO2)=28:44=7:11,
故答案为:7:11; 2:3;1:1;
(2)令CO和CO2的质量都是1g,CO的物质的量=$\frac{1g}{28g/mol}$=$\frac{1}{28}$mol,CO2的物质的量=$\frac{1g}{44g/mol}$=$\frac{1}{44}$mol,
根CO和CO2物质的量之比=$\frac{1}{28}$mol:$\frac{1}{44}$mol=11:7;
同温同压下,气体的密度之比等于其摩尔质量之比,CO2和CO的密度之比为44g/mol:28g/mol=11:7,
所含氧原子物质的量比为11:7×2=11:14;
故答案为:11:7;7:11;11:14;
(3)n(Na2X)=$\frac{1}{2}$n(Na+)=0.2mol,M(Na2X)=$\frac{15.6g}{0.2mol}$=78g/mol,X的相对原子质量为78-2×23=32,
故答案为:78g/mol;32.
点评 本题考查阿伏伽德罗定律及其推论、物质的量的计算,比较基础,注意对基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 实验目的 | 标号 |
| 检验氯化亚铁是否变质 | |
| 除去食盐中少量细砂 | |
| 除去碳酸钠固体中少量碳酸氢钠 | |
| 除去镁粉中混有的少量铝粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
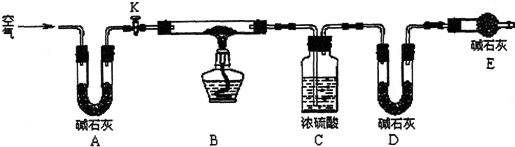
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 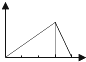 | B. | 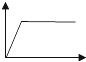 | C. | 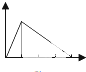 | D. |  | ||||
| E. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
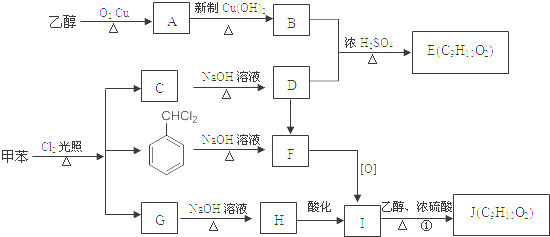

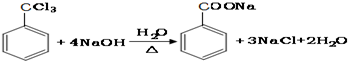 .
.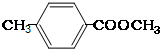 ;②
;②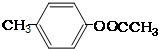 ;③
;③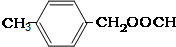 或
或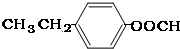 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P是氧化剂 | B. | 氧化性H2O2>Na2H2P2O6 | ||
| C. | 1mol H2O2反应,转移电子1mol | D. | Na2H2P2O6中磷元素的化合价为+3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
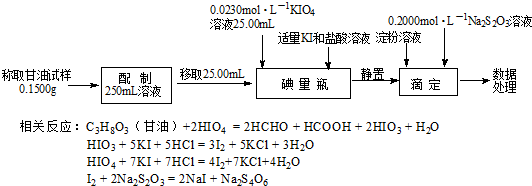
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com