
| A、反应①中,当转移0.4mol电子时生成13.6g ZnCl2 |
| B、反应①中,ZnCl2是氧化产物,ZnI2是还原产物 |
| C、反应①中,ZnCl2既是氧化产物又是还原产物 |
| D、反应②中,ICl既是氧化剂又是还原剂 |


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
| A、如将某材料分散到液体分散剂中,该分散系可发生丁达尔效应,由此可推测该材料粒子的直径为1~100nm之间 |
| B、质谱法是测定有机物组成和结构的现代分析方法之一,同位素示踪法是科学家经常使用的研究化学反应历程的手段之一 |
| C、发酵粉中含有苏打,能使焙制出的糕点疏松多孔 |
| D、高空臭氧层吸收太阳紫外线,保护地球生物;低空臭氧是污染气体,对人体有危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某钠盐溶液滴入AgNO3溶液 | 有白色沉淀 | 该钠盐不一定是NaCl |
| B | 浓硫酸与NaCl固体混合加热 | 有气体产生 | 硫酸的酸性比HCl强 |
| C | 某无色气体通入溴水中 | 溴水褪色 | 该气体一定是C2H4 |
| D | 向浓度均为0.1mol?L-1的NaCl和NaI混合溶液中滴加少量的Pb(NO3)2溶液 | 出现黄色沉淀 (PbI2) |
KSP(PbI2)<KSP(PbCl2) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发生装置与用KClO3制取O2的装置相同 |
| B、可用排饱和氯化铵溶液的方法收集氨气 |
| C、氨气的验满可以用湿润的红色石蕊试纸或沾有浓盐酸的玻璃棒放于试管口附近 |
| D、所用的铵盐不是NH4NO3,是因为NH4NO3受热易爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.0 mol/L |
| B、1.5 mol/L |
| C、0.18 mol/L |
| D、0.24 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
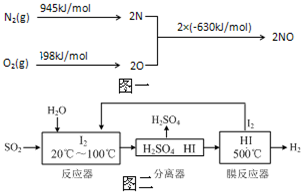 中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 充电 |
| 放电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com