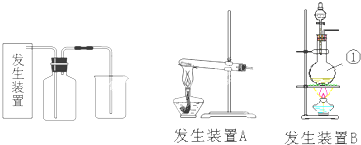
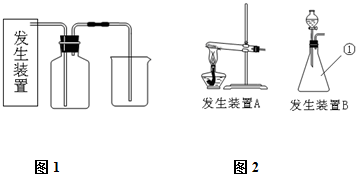
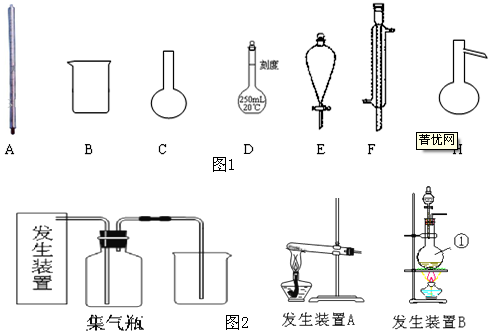
【答案】
分析:(1)实验室用浓盐酸和二氧化锰制取氯气,根据反应物、生成物和反应条件写出反应方程式;根据原子守恒计算还原剂的物质的量,根据氯气和转移电子之间的关系式计算;
(2)氯气具有氧化性,能把氯化亚铁氧化成氯化铁,铁离子和硫氰化钾溶液反应生成血红色溶液;
(3)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(4)根据转移电子守恒计算生成的氯化钠的量,根据化合价变化计算被氧化与被还原的氯元素的物质的量之比.
解答:解:(1)在加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为:MnO
2+4HCl(浓)

MnCl
2+2H
2O+Cl
2↑,该反应中作还原剂的浓盐酸反应后生成氯气,根据原子守恒知,被还原的浓盐酸的物质的量是0.6mol,反应中转移电子数=0.3mol×[0-(-1)]×2×N
A/mol=0.6N
A,
故答案为:MnO
2+4HCl(浓)
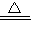
MnCl
2+2H
2O+Cl
2↑;0.6mol;0.6N
A;
(2)氯气具有氧化性,能把氯化亚铁氧化成氯化铁,离子反应方程式为:2Fe
2++Cl
2=2Fe
3++2Cl
-,铁离子和硫氰化钾溶液反应生成血红色溶液,所以看到的现象是:溶液由黄色变为血红色,
故答案为:2Fe
2++Cl
2=2Fe
3++2Cl
-;硫氰化钾溶液,溶液由黄色变为血红色;
(3)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl
2+2OH
-=Cl
-+ClO
-+H
2O,故答案为:Cl
2+2OH
-=Cl
-+ClO
-+H
2O;
(4)根据ClO
-与ClO
3-的浓度之比1:3,由Cl到ClO
-,失去1个电子,由Cl到ClO
3-,失去5个电子,一共失去1+3×5=16个电子,由Cl到Cl
-,得到1个电子,需要16个氯原子才能得到16个电子,所以被氧化的氯元素与被还原的氯元素的物质的量之比=(1+3):16=1:4,故答案为:1:4.
点评:本题考查氯气的制取、铁离子的检验、漂白粉的制取、氧化还原反应等知识点,铁离子的检验是考试热点,会描述反应现象,注意哪些特征属于反应现象,为易错点.

 MnCl2+2H2O+Cl2↑,该反应中作还原剂的浓盐酸反应后生成氯气,根据原子守恒知,被还原的浓盐酸的物质的量是0.6mol,反应中转移电子数=0.3mol×[0-(-1)]×2×NA/mol=0.6NA,
MnCl2+2H2O+Cl2↑,该反应中作还原剂的浓盐酸反应后生成氯气,根据原子守恒知,被还原的浓盐酸的物质的量是0.6mol,反应中转移电子数=0.3mol×[0-(-1)]×2×NA/mol=0.6NA, MnCl2+2H2O+Cl2↑;0.6mol;0.6NA;
MnCl2+2H2O+Cl2↑;0.6mol;0.6NA;