
在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 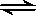 4NO2(g)+ O2(g)。反应5min后,测得N2O5的物质的量为2mol,求:(要求写详细解题过程)
4NO2(g)+ O2(g)。反应5min后,测得N2O5的物质的量为2mol,求:(要求写详细解题过程)
(1)5min末NO2的浓度?
(2)用氧气的浓度变化来表示5min内的该反应的平均速率?
(每小题3分)
(1) 2mol·L-1(2) 0.1 mol·(L·min)-1
【解析】
试题分析:根据三段式解题法,求出反应混合物各组分物质的量的变化量、5min时各组分的物质的量,
2N2O5(g)  4NO2(g)+O2(g)
4NO2(g)+O2(g)
开始(mol): 4 0 0
变化(mol): 2 4 1
5min时(mol): 2 4 1
(1)5min末NO2的浓度为4mol÷2L= 2mol·L-1。
(2)用氧气的浓度变化来表示5min内的该反应的平均速率为1mol÷2L÷5min=0.1 mol·(L·min)-1。
考点:化学平衡的计算
点评:考查反应速率、化学平衡的有关计算,难度不大,注意三段式解题法运用与基础知识积累。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)
(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)  4NO2(g)+O2(g).反应5min后,测得N2O5转化了20%,则:υ(NO2)为
4NO2(g)+O2(g).反应5min后,测得N2O5转化了20%,则:υ(NO2)为

查看答案和解析>>
科目:高中化学 来源:2014届四川省成都市高一下学期期中考试化学试卷(解析版) 题型:计算题
在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)  4NO2(g)+ O2(g)。
4NO2(g)+ O2(g)。
反应5min后,测得N2O5转化率为20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
查看答案和解析>>
科目:高中化学 来源:2014届江西省高一下学期期中考试化学试卷(解析版) 题型:计算题
在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)  4NO2(g)+
O2(g)。反应5min后,测得N2O5转化了20%,求:
4NO2(g)+
O2(g)。反应5min后,测得N2O5转化了20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
(要求写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com