
| A、①② | B、②⑤ | C、①③ | D、③⑤ |


科目:高中化学 来源: 题型:
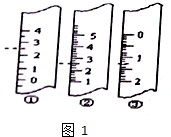 中用水稀释后转移到100mL容量瓶中定容,然后将稀释后的溶液倒入试剂瓶中.
中用水稀释后转移到100mL容量瓶中定容,然后将稀释后的溶液倒入试剂瓶中.
| 实验序号 | 待测样品溶液的体积/mL | 0.1000mol.L-1 KMnO4溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 24.98 |
| 2 | 25.00 | 1.56 | 29.30 |
| 3 | 25.00 | 1.00 | 26.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
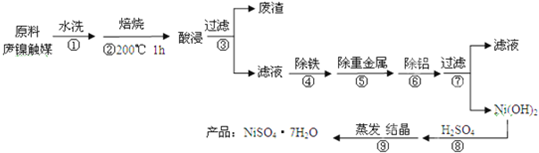
| 原料用量② m/g | 水用量 V(H2O)/ml | 硫酸用量 V(H2SO4)/ml | 浸出量 m(Ni)/g | 浸出率 E(Ni)/% |
| 100 | 200 | 10 | 11.40 | 87.69 |
| 100 | 200 | 20 | 11.60 | 89.23 |
| 100 | 200 | 50 | 11.65 | 89.62 |
| 100 | 200 | 100 | 11.66 | 89.69 |
| 100 | 200 | 150 | 11.68 | 89.85 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动了 |
| B、物质A的转化率减少了 |
| C、物质B的质量分数减少了 |
| D、x>y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯和邻甲基乙苯 |
| B、CH2=CH2和 C6H5-CH=CH2 |
| C、C2H2和C4H6 |
| D、正戊烷和2一甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定有SO42- |
| B、可能有SO42-或Ag+ |
| C、一定无Ag+ |
| D、还可能有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-4 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应HZ+Y-═HY+Z-不能发生 |
| C、此温度下,1 mol/L HZ溶液的pH=2 |
| D、此温度下,1 mol/L HX溶液的电离常数大于0.1 mol/L HX |
查看答案和解析>>
科目:高中化学 来源: 题型:
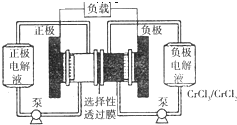 铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+
铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+ | 放电 |
| 充电 |
| A、电池充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B、电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C、电池放电时,Cl-从负极穿过选择性透过膜移向正极 |
| D、电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.008 889 |
| B、0.080 0 |
| C、0.120 0 |
| D、0.240 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com