
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键,NH5是离子化合物
C.NH5的电子式为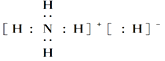
D.它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答:
族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)元素⑦的原子结构示意图为_____;元素⑩的名称为______;
(2)在这些元素中,化学性质最活泼的金属元素是____(填元素符号,下同),最不活泼的元素是___;原子半径最小的元素是_____;
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是___(填化学式,下同);具有两性的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
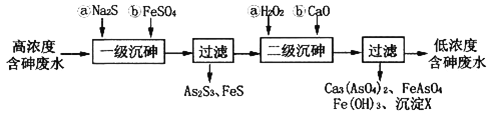
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为________________________。
(2)“一级沉砷”中FeSO4的作用是___________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为______________________________________________________________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________.
(5)步骤2的离子方程式为______________________________________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,则该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写
(1)氨气的电子式:_________,乙炔的结构简式:___________;
(2)工业上利用乙烯催化水化法制取乙醇,化学反应方程式:________反应类型:____________
(3)苯与浓硝酸在50~60℃下发生硝化反应:________反应类型:_____________;
(4)已知键能如下:
化学键 | H—H | N—N | N—H | N≡N |
键能kJ/mol | 432 | 247 | 389 | 942 |
写出N2和H2合成NH3的热化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成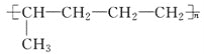 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
A. 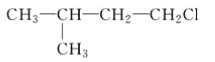 B.
B. 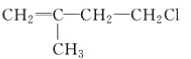 C. CH3CH2CH2ClD.
C. CH3CH2CH2ClD. 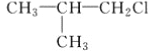
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2 g Cu和Cu2O的混合物中加入某浓度的2L稀硝酸,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入2.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法正确的是( )
A. Cu与Cu2O的物质的量之比为1∶1
B. 硝酸的物质的量浓度为1 mol·L-1
C. 产生的NO的体积为4.48 L
D. Cu、Cu2O与硝酸反应后剩余HNO3为1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法不能达到实验目的的是
A.可用丁达尔效应来区分溶液和胶体
B.用NaOH溶液除去CO2中混有的少量HCl
C.可用热分解的方法提纯混有少量CaCO3的CaO
D.向AlCl3溶液中滴加过量氨水可制得Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵明矾NH4Al(SO4)2·12H2O是分析化学常用基准试剂,其制备过程如下。下列分析不正确的是

A. 过程Ⅰ反应:2NH4HCO3+Na2SO4===2NaHCO3↓+(NH4)2SO4
B. 检验溶液B中阴离子的试剂仅需BaCl2溶液
C. 若省略过程Ⅱ则铵明矾产率明显减小
D. 向铵明矾溶液中逐滴加入NaOH溶液先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学称取9.00g淀粉溶于水,测定淀粉的水解百分率.其程序如下:
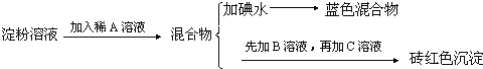
试回答下列问题:
(1)各步加入的试剂为:A_________,B_________,C_________;
(2)加入A溶液而不加入B溶液是否可以_________,其理由是_________;
(3)写出淀粉水解的方程式_________;
(4)当析出1.44g砖红色沉淀时,淀粉水解率是_________;[已知葡萄糖与Cu(OH)2反应的化学方程式为:CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com