
| µĪ¶ØŠņŗÅ | “ż²āŅŗĢå»żØMmL | ĻūŗÄKMn0ČÜŅŗĢå»żØMmL |
| 1 | 25.00 | 19.98 |
| 2 | 25.00 | 19.12 |
| 3 | 25.00 | 20.02 |
| ||
| ||
| 19.98+20.02 |
| 2 |


 ÖĒÄÜѵĮ·Į·²āæ¼ĻµĮŠ“š°ø
ÖĒÄÜѵĮ·Į·²āæ¼ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
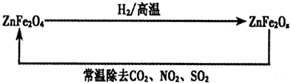
| A£®·“Ó¦O3+OØT2O2µÄ”÷H=E1-E2 |
| B£®·“Ó¦O3+OØT2O2µÄ”÷H=E2-E3 |
| C£®·“Ó¦O3+OØT2O2ŹĒĪüČČ·“Ó¦ |
| D£®·“Ó¦O3+OØT2O2µÄ”÷H=”÷H1+”÷H2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
| »ÆѧŹ½ | CO£Øg£© | H2£Øg£© | CH3OH£Øl£© |
| ”÷H/£ØkJ?mol-1£© | -283.0 | -285.8 | -726.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
| 1 |
| 2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĪüČČ·“Ó¦ | B£®·ÅČČ·“Ó¦ |
| C£®ģŲŌö¼Ó·“Ó¦ | D£®ģŲŌö¼Ó»ņÕß·ÅČČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®øĆ·“Ó¦µÄ”÷S£¼0 |
| B£®øĆ·“Ó¦ŌŚČĪŗĪĪĀ¶ČĻĀ¾łÄÜ×Ō·¢½ųŠŠ |
| C£®ĻņČŻĘ÷ÖŠ³äČėÉŁĮæHe£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ |
| D£®ÉżøßĪĀ¶ČĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®2N2O5(g)£½4NO2(g)£«O2(g)£»¦¤H£¾0 |
| B£®2CO(g)=2C(s)+O2(g)£»¦¤H£¾0 |
| C£®(NH4)2CO3(s)£½NH4HCO3(s)£«NH3(g)£»¦¤H£¾0 |
| D£®2H2(g)£«O2(g)£½2H2O(l)£»¦¤H£¼0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĀČ»ÆÄĘČÜÓŚĖ®ÖŠ | B£®NH3(g)ŗĶHCl(g)·“Ӧɜ³ÉNH4Cl£Øs£© |
| C£®øɱłµÄÉż»Ŗ | D£®CaCO3(s)·Ö½āĪŖCaO(s)ŗĶCO2(g) |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com