
| ||
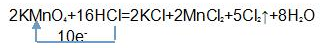 ,
,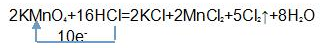 ;
;
| ||


科目:高中化学 来源: 题型:
| A、向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+ |
| B、浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同 |
| C、向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42- |
| D、常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液与CH3COOH溶液混合至中性后:c(CH3COO-)=c(Na+)=c(H+)=c(OH-) |
| B、pH=3的CH3COOH溶液与pH=11的KOH溶液等体积混合后:c(K+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、pH=2的HNO3溶液与pH=12的NH3?H2O溶液等体积混合后:c(NH4+)>c(H+)>c(OH-)>c(NO3-) |
| D、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,c(NH4+)大小顺序:①=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH2CH═CH2 |
| B、CH2═CH-CH2-CH═CH2 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
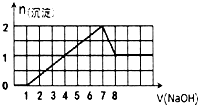 某溶液中可能含有H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42-,CO32-等离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列判断正确的是( )
某溶液中可能含有H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42-,CO32-等离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列判断正确的是( )| A、原溶液中一定含有H+、Fe3+、Al3+,可能含Ba2+ |
| B、原溶液中含Fe3+和Al3+,物质的量之比为l:l |
| C、原溶液中可能含有CO32- |
| D、反应最后形成的溶液中含有的溶质只有NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一小块钠长期露置在空气中,最终变成NaOH固体 |
| B、氯化钠是一种性质稳定的化合物,可用作调味品,灼烧时火焰呈无色 |
| C、过氧化钠有很强的还原性,可作为潜水艇中的供氧剂 |
| D、向苯和水的混合体系中加入钠,钠块会在分界面上下不停跳动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、氧化还原反应 | B、分解反应 |
| C、离子反应 | D、吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com