
| A�� | ��Ҫ���ȵķ�Ӧ˵���������ȷ�Ӧ | |
| B�� | ������������Ӧ���ɵ�����ˮ������Һ̬ˮ��ǰ�߷ų��������� | |
| C�� | ��ϡ��Һ�У�H+��aq��+OH-��aq���TH2O��l������H=-57.3 kJ/mol��������0.5 mol H2SO4��ϡ�����뺬1.1 mol NaOH��ϡ��Һ��ϣ��ų����������� 57.3 kJ | |
| D�� | 1 mol S��ȫȼ�շ���297.3 kJ�����Ȼ�ѧ����ʽΪ��S+O2�TSO2��H=-297.3 kJ/mol |
���� A���еķ��ȷ�ӦҲ����Ҫ���ȵģ�
B��Һ̬ˮ��Ϊ��̬ˮ�Ĺ��������ȵģ�
C�������Ȼ�ѧ����ʽ���������ش�
D�������Ȼ�ѧ����ʽ����д�������ش�
��� �⣺A�����ȷ�Ӧ��Ҫ�����²��ܷ������������Ƿ��ȷ�Ӧ����A����
B����ΪҺ̬ˮ��Ϊ��̬ˮ�Ĺ��������ȵģ�����������������Ӧ���ɵ�����ˮ������Һ̬ˮ�����߷ų������࣬��B����
C������0.5molH2SO4��ϡ���ἴH+��1mol���뺬1molNaOH��OH-��1mol����Һ��ϣ��ų�����������57.3 kJ����C��ȷ��
D��1molS��ȫȼ�շ���297.3 kJ�����Ȼ�ѧ����ʽΪ��S��s��+O2��g���TSO2��g������H=-297.3 kJ/mol����D����
��ѡC��
���� ���⿼��ѧ���Ȼ�ѧ����ʽ��ʨЫ�������Լ��к��ȵĸ����֪ʶ�������ۺ�֪ʶ�Ŀ��飬�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����2NA����ԭ�ӵĺ����ڱ�״���µ����ԼΪ22.4L | |
| B�� | 25�棬1.01��105 Pa��64g SO2�к��е�Oԭ����Ϊ2NA | |
| C�� | �ڳ��³�ѹ�£�22.4L Cl2���еķ�����ΪNA | |
| D�� | ��״���£�11.2LCH3CH2OH���ƾ������еķ�����Ϊ0.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼ԭ�Ӳ�ȡsp�ӻ� | B�� | CO2�����������ͽṹ | ||
| C�� | �ɱ������к��зǼ��Լ� | D�� | CO2����ˮ�˷��˷��Ӽ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
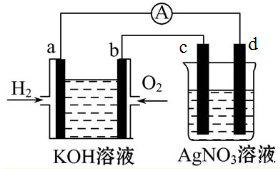
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �ò�����Ѹ�ٽ�����ͼ��ʾװ���ڣ�С�ձ��벣��Ƭ֮����һ����ˮ���Ĺ�������Ժ��������ձ�ʱ���ֲ���Ƭ���ձ�ճ����һ�������йظ÷�Ӧ��˵������ȷ���ǣ�������
�ò�����Ѹ�ٽ�����ͼ��ʾװ���ڣ�С�ձ��벣��Ƭ֮����һ����ˮ���Ĺ�������Ժ��������ձ�ʱ���ֲ���Ƭ���ձ�ճ����һ�������йظ÷�Ӧ��˵������ȷ���ǣ�������| A�� | ��Ӧ���л�ѧ��ת��Ϊ���� | B�� | ��Ӧ�е�������ϵ��ͼ�� | ||
| C�� | �����ȷ�Ӧ | D�� | ��ѧ�����ܼ��ܣ���Ӧ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com