
科目:高中化学 来源:不详 题型:填空题
| 含氧酸 | X | Y | Z | W |
| 含氧酸质量/g | 25.2 | a | 3.1 | 10.5 |
| 生成物U/g | 3.2 | / | / | 3.2 |
| 生成物V/g | 3.6 | 0.9 | 0.9 | / |
| 生成物Q/g | 18.4 | 3.2 | b | c |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若R、M的最高价氧化物的水化物是碱,则M(OH)n+1的碱性比R(OH)n的碱性强 |
| B.若T(OH)n为两性氢氧化物,则J元素形成的单质存在同素异形现象 |
| C.若J的氢化物是常见的强电解质,则M单质是光导纤维的主要成分 |
| D.若M的最高正价为+4,则五种元素全是非金属元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
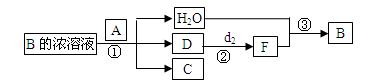
 是 ;在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 。
是 ;在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com