
【题目】24mL浓度为0.05mol·L-1Na2SO3溶液恰好与20mL 浓度为0.02mol·L-1的K2X2O7溶液完全反应,已知Na2SO3可被K2X2O7氧化为Na2SO4,则元素X在还原产物中的化合价为下列的
A. +2 价 B. +3 价 C. +4价 D. +5价
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
实验 | 消耗0.1000molL﹣1的 | 待测氢氧化钠 |
1 | 29.02 | 25.00 |
2 | 28.01 | 25.00 |
3 | 27.99 | 25.00 |
(1)如图所示A的pH范围使用的指示剂是;
(2)用0.1000molL﹣1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如表所示.则待测氢氧化钠的物质的量浓度是molL﹣1 . 在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将(填“偏高”、“偏低”或“不影响”).
(3)下列关于上述中和滴定过程中的操作正确的是(填序号)
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量筒量取.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用洁净的铂丝蘸取无色溶液,在无色灯焰上观察时看到黄色火焰,则下列有关叙述正确的是( )
A. 用铂丝做焰色反应实验,每次做完后都需要用硫酸洗涤
B. 该溶液一定含有Na+,也可能含有K+
C. 该溶液不含Na+,可能含K+
D. 该溶液可能含Na+或K+中的一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是沟通宏观和微观的桥梁,请回答下列问题。
(1)同温同压下的两个相同容器中分别装有NO和NO2气体,则两瓶气体中,原子数之比是___,质量之比是___,密度之比是___分子数之比是___.
(2)下列所给出的几组物质中:含有分子数最少的是___;含有原子数最多的是___;标准状况下体积最小的是___.
①1gH2; ②2.408×1023个CH4; ③10.8gH2O; ④标准状况下6.72LCO2.
(3)设NA表示阿伏伽德罗常数,如果x g某气体含有的分子数是y,则z g该气体在标准状况下的体积是 _________________L(用含NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种短周期元素,A2﹣和B+具有相同的电子构型,C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子. 回答下列问题:
(1)C原子的核外电子排布式为 .
(2)单质A有两种同素异形体,其中沸点高的是(填分子式),原因是;A、B、D三元素组成的化合物所属的晶体类型是 .
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为 , 中心原子的杂化轨道类型为 .
(4)A和B能够形成化合物1:1的化合物,写出此化合物的电子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示自然界中的氮循环,相关说法正确的是( )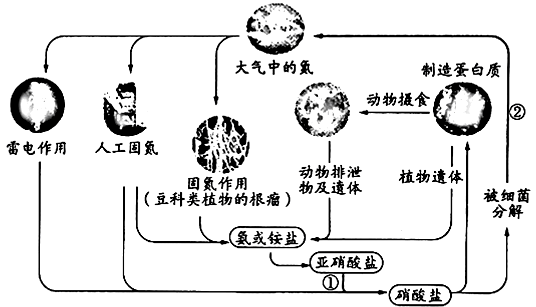
A.“雷电作用”中发生的反应是:N2+ 2O2 ![]() 2NO2
2NO2
B.“人工固氮”过程中,氮元素一定被还原
C.①中涉及的反应可能有:2NO2-+O2 = 2NO3-
D.②中涉及的反应可能有:2NO3-+12H+ = N2+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。( )
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是
A.0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B.Fe3+的作用是加快过氧化氢的分解速率
C.反应①是吸热反应、反应②是放热反应
D.反应2H2O2(aq) ![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温容器中加入1molN2和3molH2 , 达到平衡时NH3的体积分数为m%.若N2、H2、NH3的起始加入量分别为xmol、ymol、zmol,达到平衡时NH3的体积分数仍为m%.
(1)该容器恒容,则x、y、z应满足的关系是 .
(2)该容器恒压,则x、y、z应满足的关系是 .
(3)设前者达到平衡时生成NH3为amol,则后者达到平衡时生成NH3=mol(用a、x、z表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com