
 (1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断:
(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断:分析 (1)①根据电池反应式知,Pb元素化合价由0价、+4价变为+2价,得电子化合价降低的反应物为正极、失电子化合价升高的金属为负极;
②放电时,H2SO4参加反应导致溶液中c( H+)降低;
③放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;
④电流从正极沿导线流向负极;
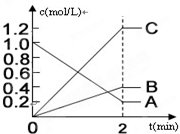
(2)①根据图象中A、B、C浓度的变化趋势判断反应物和生成物;
②判断出反应物和生成物,根据浓度变化之比等于化学剂量数之比确定反应的化学方程式;
③根据v=$\frac{△c}{△t}$计算反应速率.
解答 解:(1)①根据电池反应式知,Pb元素化合价由0价、+4价变为+2价,失电子化合价升高的金属为负极,则Pb为负极,故答案为:Pb;
②放电时,H2SO4参加反应导致溶液中c( H+)降低,则溶液pH增大、酸性减小,故答案为:减小;
③放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,故答案为:负;
④电流从正极PbO2沿导线流向负极Pb,故答案为:正;负;
(2)①由图象可知,在反应中,A的浓度逐渐减小,B、C的浓度逐渐增大,则A为反应物,B、C为生成物,故答案为:A;
②A为反应物,B、C为生成物,相同时间内浓度的变化比值为c(A):c(B):c(C)=(1.0-0.2):0.4:1.2=2:1:3,化学反应中浓度变化之比等于化学剂量数之比,则化学方程式为2A?B+3C,故答案为:2A?B+3C;
③在0~2min,该反应用A表示的平均反应速率为:v=$\frac{△c}{△t}$=$\frac{1.0mol/L-0.2mol/L}{2min}$=0.4mol•L-1•min-1,故答案为:0.4mol•L-1•min-1.
点评 本题考查了原电池原理,化学平衡的图象问题,明确正负极上发生反应及元素化合价变化即可解答,知道电流方向、电解质溶液中阴阳离子移动方向等知识点,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 | |
| B. | 使用催化剂,降低反应的活化能,增大单位体积内活化分子百分数,反应速率增大 | |
| C. | SO2(g)+2CO(g)?2CO2(g)+S(l)达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高 | |
| D. | 恒温恒压下,向一平衡体系中通入惰性气体,反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 | |
| B. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| C. | 在农村推广使用沼气 | |
| D. | 减少资源消耗、增加资源的重复使用和资源的循环再生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨是人类科学技术上的一项重大突破,其反应原理为:
合成氨是人类科学技术上的一项重大突破,其反应原理为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 已知中和热为△H=-57.4 kJ•mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 | |
| D. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过煤的直接或间接液化可以获得各种芳香烃 | |
| B. | 通过石油的催化重整等工艺可获取芳香烃 | |
| C. | 石油的裂化的目的主要是为了提高轻质油的产量 | |
| D. | 石油的裂解的目的主要是为了获取不饱和烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com