
【题目】在下图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4液滴;电源有a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如图所示。

则:①标出电源的正、负极:a为________极,b为______极。
②在湿的Na2SO4滤纸条中部的KMnO4液滴处有什么现象发生?__________________
③写出电极反应式:C中______________,D中______________。
④若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,则检流计的指针是否移动?___________(填“是”或“否”),其理由________________。写出电极反应式:A中 ,B中__ _。
【答案】
①负极;正极;
②紫色向D方向移动,两极有气体产生;
③是;
④O2+2H2O+4e-=4OH-;2H2+4OH--4e-=4H2O。
【解析】
试题分析:①切断K1,合闭K2、K3通直流电,电极A、B及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,B极上气体体积是A极上气体体积的2倍,所以B极上得氢气,A极上得到氧气,所以B极是阴极,A极是阳极,故a是负极,b是正极,故答案为:负极;正极;
②浸有硫酸钠的滤纸和电极C、D与电源也构成了电解池,因为a是负极,b是正极,所以C是阴极,D是阳极,电解质溶液中的阳离子钾离子向阴极移动,阴离子高锰酸根离子向阳极移动,所以D极呈紫色;电解质溶液中氢离子和氢氧根离子放电,所以在两极上都得到气体,故答案为:紫色向D方向移动,两极有气体产生;
③切断K2、K3,合闭K1,电解一段时间后,A、B中均有气体包围电极.此装置构成氢氧燃料原电池,所以有电流通过,电流表的指针移动,故答案为:是;
④若电解一段时间后,A、B中均有气体包围电极.此时切断K2、K3,闭合K1,构成氢氧燃料电池,在燃料电池中,燃料氢气B为负极,方程式为2H2+4OH--4e-=4H2O;氧气A作正极,方程式为O2+2H2O+4e-=4OH-;故答案为:O2+2H2O+4e-=4OH-;2H2+4OH--4e-=4H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

正极的电极反应式是 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层。
① 对比实验,结果如图所示,可得到的结论是 。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因: 。
II.高铁酸钠Na2FeO4 是一种新型净水剂。
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH= 2Na2FeO4+3X+5H2O,则X的化学式为__________。
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
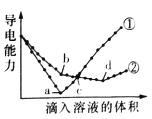
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有①Na+ 、②Ba2 +、 ③Cl一、 ④Br一、⑤SO32一、⑥SO42一 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。

下列结论不正确的是( )
A.肯定没有的离子是② B.不能确定的离子是③⑥
C.肯定含有的离子是①③④⑤ D.肯定含有的离子是①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式:2AgCl+ Mg = Mg2++ 2Ag+2Cl-。有关该电池的说法正确的是( )
A. Mg为电池的正极 B. 负极反应为AgCl+e-=Ag+Cl-
C. 不能被KCl溶液激活 D. 可用于海上应急照明供电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列说法正确的是( )
A.将pH=2的酸溶液稀释10倍,溶液的pH一定变为3
B.将pH=2的盐酸溶液和pH=4的盐酸溶液等体积混合后,溶滚的pH变为3
C.将pH=12的Ba(OH)2溶液稀释10倍,溶液的pH变为13
D.将pH=a的盐酸与pH=b的NaOH溶液等体积混合后,若pH=7, 则a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将少量的Fe3O4溶解在过量的稀HNO3中Fe3O4+8H+=Fe2++2Fe3++4H2O | 正确,Fe2+与Fe3+物质的量之比为1:2 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应 Ba2++HCO3-+OH-=BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合: 2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2∶3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的NaSO4、KAl(SO4)2、Al2(SO4)3,三种溶液分别与等体积、等浓度的BaCl2溶液完全反应,则三溶液的物质的量浓度之比为
A.1:2:3
B.3:2:1
C.6:3:2
D.2:3:6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com